Giải Câu 9.12 Bài 9. Liên kết ion (trang 30, 31, 32) – SBT Hóa 10 Chân trời sáng tạo. Hướng dẫn: Bước 1: So sánh điện tích nguyên tử của các nguyên tố.
Câu hỏi/Đề bài:
X, Y, Z là các hợp chất ion thuộc trong số các chất sau: NaF, MgO và MgCl2 Nhiệt độ nóng chảy của các hợp chất X, Y, Z được thể hiện qua biểu đồ: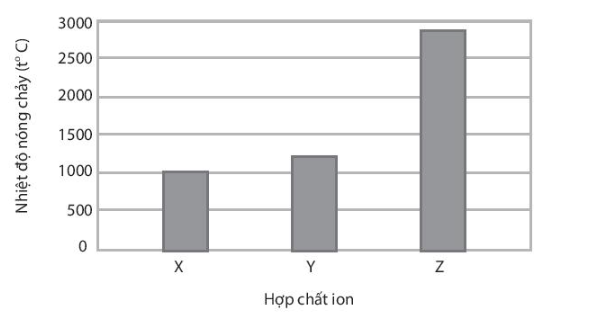
Trình bày cách xác định các chất X, Y, Z
Hướng dẫn:
– Bước 1: So sánh điện tích nguyên tử của các nguyên tố
– Bước 2: So sánh bán kính nguyên tử của các nguyên tố
– Bước 3: Dựa vào nhận xét
+ “hợp chất ion được hình thành bởi các ion có điện tích lớn hơn sẽ tạo ra liên kết mạnh hơn và các hợp chất ion có độ dài liên kết ngắn hơn sẽ hình thành liên kết mạnh hơn”
+ Hợp chất ion nào có liên kết bền hơn sẽ có nhiệt độ nóng chảy cao hơn
Lời giải:
– So sánh giữa MgO và MgCl2
+ Ion O2- có điện tích lớn hơn ion Cl–
+ Kích thước ion O2- nhỏ hơn ion Cl–
=> Liên kết trong MgO bền hơn so với MgCl2 => MgO có nhiệt độ nóng chảy cao hơn so với MgCl2
– So sánh giữa MgCl2 và NaF
+ Ion Cl– và ion F– có cùng điện tích
+ Kích thước ion F– nhỏ hơn nhiều ion Cl– (do cùng nhóm)
+ Ion Mg2+ có điện tích lớn hơn ion Na+
+ Kích thước ion Mg2+ nhỏ hơn không nhiều ion Na+ (do cùng chu kì)
=> Liên kết trong NaF bền hơn so với MgCl2 => NaF có nhiệt độ nóng chảy cao hơn so với MgCl2
=> Vậy X là MgCl2; Y là NaF và Z là MgO