Giải Câu 4.13 Bài 4. Cấu trúc lớp vỏ electron của nguyên tử (trang 14, 15, 16) – SBT Hóa 10 Chân trời sáng tạo. Tham khảo: Dựa vào.
Câu hỏi/Đề bài:
Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử 12Mg và 24Cr. Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Hướng dẫn:
Dựa vào
– Các bước viết cấu hình electron của nguyên tử
+ Bước 1: Xác định số electron của nguyên tử
+ Bước 2: Các electron được phân bố theo thứ tự các AO có mức năng lượng tăng dần, theo các nguyên lí và quy tắc phân bố electron trong phân tử
+ Bước 3: Viết cấu hình electron theo thứ tự các phân lớp trong một lớp và theo thứ tự của các lớp electron
– Viết cấu hình electron dưới dạng ô lượng tử dựa vào:
+ Nguyên lí Pauli: Mỗi orbital chỉ chứa tối đa 2 electron và có chiều tự quay ngược nhau
+ Quy tắc Hund: Trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa
– Dự đoán tính kim loại/ phi kim của nguyên tử
Lời giải:
– Nguyên tử Mg có 12 electron
=> Phân mức năng lượng electron: 1s22s22p63s2
=> Cấu hình electron của nguyên tử Mg: 1s22s22p63s2
=> Cấu hình electron dưới dạng ô lượng tử
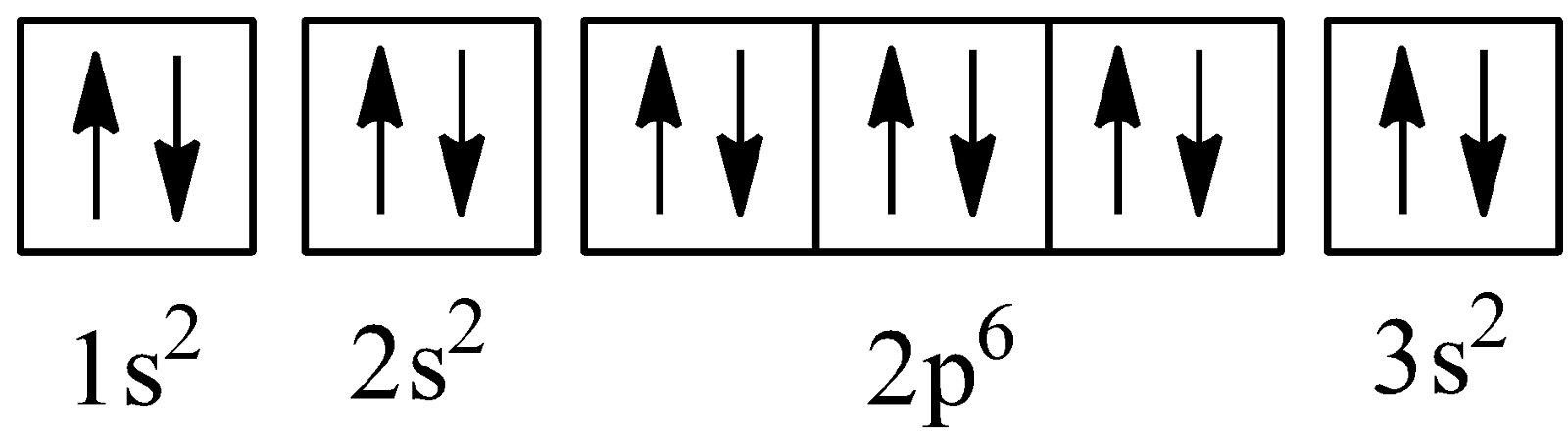
=> Mg là nguyên tố nhóm A và có 2 electron ở lớp ngoài cùng nên Mg là kim loại
– Nguyên tử Cr có 24 electron
=> Phân mức năng lượng electron: 1s22s22p63s23p64s13d5
=> Cấu hình electron của nguyên tử Cr: 1s22s22p63s23p63d54s1
=> Cấu hình electron dưới dạng ô lượng tử:
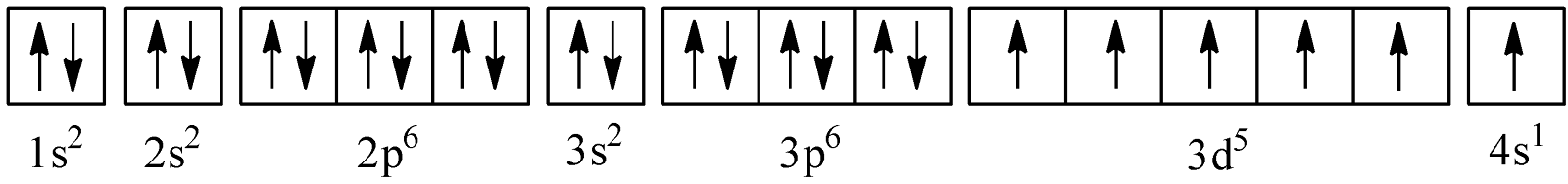
=> Cr là nguyên tố nhóm B nên Cr là kim loại