Hướng dẫn giải Câu 14.14 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học (trang 56, 57, 58) – SBT Hóa 10 Chân trời sáng tạo. Hướng dẫn: Dựa vào công thức \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \.
Câu hỏi/Đề bài:
Cho phản ứng phân huỷ hydrazine:
N2H4(g) -> N2(g) + 2H2(g)
a) Tính \({\Delta _r}H_{298}^0\) theo năng lượng liên kết của phản ứng trên.
b) Hydrazine (N2H4) là chất lỏng ở điều kiện thường (sôi ở 114°C, khối lượng riêng 1,021 g/cm3). Hãy đề xuất lí do N2H4 được sử dụng làm nhiên liệu trong động cơ tên lửa. Biết Eb(N-N) = 160 kJ/mol; Eb(N-H) = 391 kJ/mol, Eb(N≡N) = 945 kJ/mol; Eb(H-H) = 432 kJ/mol.
Hướng dẫn:
Dựa vào công thức \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \) và bảng số liệu
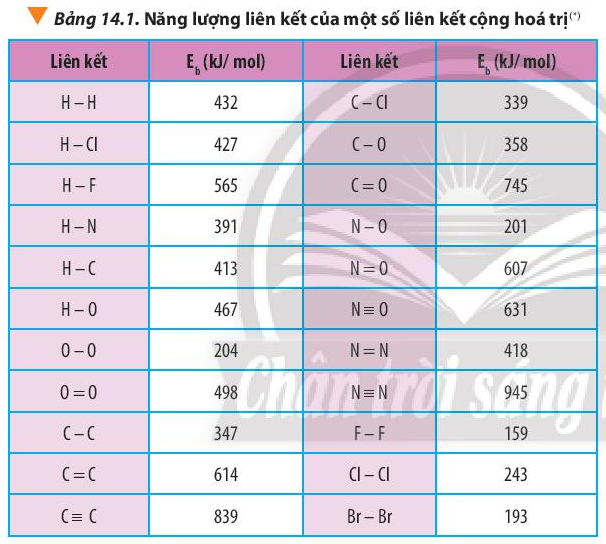
Lời giải:
a) – Biến thiên enthalpy của phản ứng N2H4(g) -> N2(g) + 2H2(g) là:
\({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \)
=> \({\Delta _r}H_{298}^0 = {E_b}(N – N) + 4.{E_b}(N – H) – {E_b}(N \equiv N) – 2.{E_b}(H – H)\)
=> \({\Delta _r}H_{298}^0 = 160 + 4.391 – 945 – 2.432 = – 85kJ\)
b) Các lí do N2H4 được sử dụng làm nhiên liệu trong động cơ tên lửa:
– N2H4 là chất lỏng nên dễ bảo quản (nếu là chất khí cần nén ở điều kiện áp suất cao dễ gây nguy hiểm và tốn công bảo quản)
– Phương trình có \({\Delta _r}H_{298}^0 = – 85kJ\)< 0 " Phản ứng tự xảy ra mà không cần cung cấp năng lượng
– 1 mol N2H4 ở dạng lỏng sau phản ứng sẽ sinh ra tổng cộng 3 mol khí ” tạo được áp suất lớn để đẩy tên lửa bay lên