Trả lời Câu 14.13 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học (trang 56, 57, 58) – SBT Hóa 10 Chân trời sáng tạo. Hướng dẫn: Dựa vào công thức tính: \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} – \sum {{\Delta _r}H_{298}^0(cd)} \.
Câu hỏi/Đề bài:
Cho phương trình hoá học của phản ứng:
C2H4(g) + H2O(l) -> C2H5OH(l)
Tính biến thiên enthalpy của phản ứng theo nhiệt tạo thành chuẩn của các chất (Bảng 13.1 SGK).
Hướng dẫn:
Dựa vào công thức tính: \({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} – \sum {{\Delta _r}H_{298}^0(cd)} \) và bảng số liệu
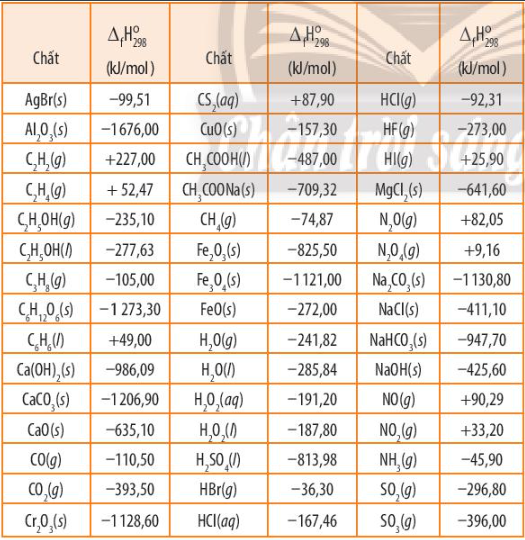
Lời giải:
– Biến thiên enthalpy của phản ứng C2H4(g) + H2O(l) -> C2H5OH(l) là:
\({\Delta _r}H_{298}^0 = \sum {{\Delta _r}H_{298}^0(sp)} – \sum {{\Delta _r}H_{298}^0(cd)} \)
=> \({\Delta _r}H_{298}^0 = 2.{\Delta _f}H_{298}^0({C_2}{H_5}OH) – {\Delta _f}H_{298}^0({C_2}{H_4}) – {\Delta _f}H_{298}^0({H_2}O)\)
=> \({\Delta _r}H_{298}^0 = – 277,63 – (+ 52,47) – (- 285,84) = – 44,26kJ\)