Hướng dẫn giải Đề thi giữa kì 1 KHTN 8 Cánh diều – Đề số 4 – Đề thi giữa kì 1 – Đề số 4 – Đề thi đề kiểm tra KHTN lớp 8 Cánh diều. Câu 1: Công dụng của ống nghiệm là A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm. C….
Đề thi
I. Trắc nghiệm
Câu 1: Công dụng của ống nghiệm là
A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm.
C. đun nóng hóa chất. D. bảo quản hóa chất.
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học?
A. Bóng đèn phát sáng, kèm theo tỏa nhiệt.
B. Hòa tan đường vào nước để được nước đường.
C. Đun nóng đường, đường chảy rồi chuyển màu đen, có mùi hắc.
D. Trời nắng, nước bốc hơi hình thành mây.
Câu 3: Cho phản ứng: copper + sulfur → copper sulfur. Số chất tham gia trong phản ứng trên là:
A. 3 B. 4 C. 2 D. 1
Câu 4: Phát biểu nào sau đây đúng?
A. Trong phản ứng hoá học, các nguyên tử bị phá vỡ.
B. Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ.
C. Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ.
D. Trong phản ứng hoá học các phân tử được bảo toàn.
Câu 5: Thể tích của 0,25 mol khí nitrogen ở điều kiện chuẩn là (làm tròn đến số thập phân thứ nhất):
A. 6,2 lít B. 7,0 lít C. 6,5 lít D. 5,6 lít
Câu 6: Một lá sắt (iron) nặng 28 g để ngoài không khí, xảy ra phản ứng với oxygen, tạo ra gỉ sắt. Sau một thời gian, cân lại lá sắt, thấy khối lượng thu được là 31,2 g. Khối lượng khí oxygen đã phản ứng là
A. 3,2 g.
B. 1,6 g.
C. 6,4g.
D. 24,8 g.
Câu 7: Khối lượng NaOH có trong 300 m L dung dịch nồng độ 0,15 M là
A. 1,8 g.
B. 0,045 g.
C. 4,5g.
D. 0,125g.
Câu 8: Đốt cháy hoàn toàn a gam bột aluminium cần dùng hết 19,2 gam khí O2 và thu được b gam aluminium oxide (Al2O3) sau khi kết thúc phản ứng. Giá trị của a và b lần lượt là
A. 21,6 và 40,8.
B. 91,8 và 12,15.
C. 40,8 và 21,6.
D. 12,15 và 91,8.
Câu 9: Chất xúc tác là chất
A. làm tăng tốc độ của phản ứng
B. làm tăng tốc độ của phản ứng nhưng không bị thay đổi sau phản ứng.
C. làm tăng tốc độ của phản ứng và bị thay đổi sau phản ứng.
D. làm tăng tốc độ của phản ứng và bị thay đổi sau phản ứng.
Câu 10: Công thức hóa học của acid có trong dịch vị dạ dày là
A. CH3COOH.
B. H2SO4
C. HNO3
D. HCl
Câu 11: Dãy gồm các dung dịch nào sau đây làm đổi màu quỳ tím thành xanh?
A. NaOH, BaCl2, HBr, KOH.
B. NaOH, Na2SO4, KCl, H2O2.
C. NaOH, Ba(OH)2, Ca(OH)2, KOH.
D. NaOH, NaNO3, KOH, HNO3.
Câu 12: Chất nào sau đây tác dụng được với dung dịch HCl?
A. Fe2O3.
B. NaCl.
C. CO2.
D. HNO3.
Câu 13: Cho các chất sau: KCl, NaOH, MgSO4, HNO3, P2O5, NaNO3. Số chất thuộc loại muối là
A. 1. B. 2. C. 3. D. 4.
Câu 14: Dung dịch acid thường có giá trị PH là:
A.pH > 7 B. pH 14
Câu 15: Chất nào sau đây trong phân lân, cung cấp nguyên tố đa lượng cho cây trồng?
A. MgCl2. B. Na2CO3. C. Ca(H2PO4)2. D. CaSO4.
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau:

Câu 2: Cho một thanh sắt (Fe) vào cốc đựng 200 mL dung dịch CuSO4 nồng độ a (M). Sau khi phản ứng hoàn toàn, đồng sinh ra bám hết vào thanh sắt. Cân lại thanh sắt thấy khối lượng tăng thêm 0,8 g. Xác định giá trị của a.
Đáp án
Phần trắc nghiệm
|
1A |
2C |
3C |
4B |
5A |
6A |
7A |
8A |
|
9B |
10D |
11C |
12A |
13C |
14B |
15C |
|
Câu 1: Công dụng của ống nghiệm là
A. chứa hóa chất thí nghiệm. B. cố định ống nghiệm.
C. đun nóng hóa chất. D. bảo quản hóa chất.
Hướng dẫn:
Công dụng của ống nghiệm là chứa hóa chất thí nghiệm
Lời giải:
Đáp án A
Câu 2: Trong các quá trình sau, quá trình nào xảy ra biến đổi hóa học?
A. Bóng đèn phát sáng, kèm theo tỏa nhiệt.
B. Hòa tan đường vào nước để được nước đường.
C. Đun nóng đường, đường chảy rồi chuyển màu đen, có mùi hắc.
D. Trời nắng, nước bốc hơi hình thành mây.
Hướng dẫn:
Quá trình biến đổi hóa học có sự thay đổi về chất
Lời giải:
Đáp án C
Câu 3: Cho phản ứng: copper + sulfur → copper sulfur. Số chất tham gia trong phản ứng trên là:
A. 3 B. 4 C. 2 D. 1
Hướng dẫn:
Chất tham gia là chất ban đầu của phản ứng
Lời giải:
Đáp án C
Câu 4: Phát biểu nào sau đây đúng?
A. Trong phản ứng hoá học, các nguyên tử bị phá vỡ.
B. Trong phản ứng hoá học, liên kết trong các phân tử bị phá vỡ.
C. Trong phản ứng hoá học, liên kết trong các phân tử không bị phá vỡ.
D. Trong phản ứng hoá học các phân tử được bảo toàn.
Hướng dẫn:
Trong phản ứng hóa học số lượng nguyên tử giữ nguyên, liên kết giữa các phân tử bị phá vỡ
Lời giải:
Đáp án B
Câu 5: Thể tích của 0,25 mol khí nitrogen ở điều kiện chuẩn là (làm tròn đến số thập phân thứ nhất):
A. 6,2 lít B. 7,0 lít C. 6,5 lít D. 5,6 lít
Hướng dẫn:
Dựa vào công thức tính thể tích khí: V = n.24,79 lít
Lời giải:
V = 0,25 . 24,79 = 6,2 lít
Đáp án A
Câu 6: Một lá sắt (iron) nặng 28 g để ngoài không khí, xảy ra phản ứng với oxygen, tạo ra gỉ sắt. Sau một thời gian, cân lại lá sắt, thấy khối lượng thu được là 31,2 g. Khối lượng khí oxygen đã phản ứng là
A. 3,2 g.
B. 1,6 g.
C. 6,4g.
D. 24,8 g.
Hướng dẫn:
Dựa vào định luật bảo toàn khối lượng
Lời giải:
m Fe + m O2 = m sau phản ứng
=> m O2 = 31,2 – 28 = 3,2g
Đáp án A
Câu 7: Khối lượng NaOH có trong 300 m L dung dịch nồng độ 0,15 M là
A. 1,8 g.
B. 0,045 g.
C. 4,5g.
D. 0,125g.
Hướng dẫn:
Tính số mol NaOH để tính số gam NaOH
Lời giải:
n NaOH = CM . V = 0,3 . 0,15 = 0,045 mol
m NaOH = 0,045 . 40 = 1,8g
Đáp án A
Câu 8: Đốt cháy hoàn toàn a gam bột aluminium cần dùng hết 19,2 gam khí O2 và thu được b gam aluminium oxide (Al2O3) sau khi kết thúc phản ứng. Giá trị của a và b lần lượt là
A. 21,6 và 40,8.
B. 91,8 và 12,15.
C. 40,8 và 21,6.
D. 12,15 và 91,8.
Hướng dẫn:
Dựa vào số mol O2 và phương trình hóa học để tính mol Al và Al2O3
Lời giải chi tiét
n O2 = 19,2 :32 = 0,6 mol
\(\begin{array}{l}4Al + 3{O_2} \to 2A{l_2}{O_3}\\0,8 \leftarrow 0,6 \to 0,4\end{array}\)
m Al = 0,8 . 27 = 21,6g
m Al2O3 = 0,4 . 102 = 40,8g
Đáp án A
Câu 9: Chất xúc tác là chất
A. làm tăng tốc độ của phản ứng
B. làm tăng tốc độ của phản ứng nhưng không bị thay đổi sau phản ứng.
C. làm tăng tốc độ của phản ứng và bị thay đổi sau phản ứng.
D. làm tăng tốc độ của phản ứng và bị thay đổi sau phản ứng.
Lời giải:
Đáp án B
Câu 10: Công thức hóa học của acid có trong dịch vị dạ dày là
A. CH3COOH.
B. H2SO4
C. HNO3
D. HCl
Hướng dẫn:
Dung dịch acid có trong dịch vị dạ dày là HCl
Lời giải:
Đáp án D
Câu 11: Dãy gồm các dung dịch nào sau đây làm đổi màu quỳ tím thành xanh?
A. NaOH, BaCl2, HBr, KOH.
B. NaOH, Na2SO4, KCl, H2O2.
C. NaOH, Ba(OH)2, Ca(OH)2, KOH.
D. NaOH, NaNO3, KOH, HNO3.
Hướng dẫn:
Dung dịch base làm quỳ tím chuyển thành màu xanh
Lời giải chi tiết
Đáp án C
Câu 12: Chất nào sau đây tác dụng được với dung dịch HCl?
A. Fe2O3.
B. NaCl.
C. CO2.
D. HNO3.
Hướng dẫn:
HCl tác dụng được với kim loại, oxide base
Lời giải:
Đáp án A
Câu 13:Cho các chất sau: KCl, NaOH, MgSO4, HNO3, P2O5, NaNO3. Số chất thuộc loại muối là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn:
Dựa vào khái niệm của muối
Lời giải:
KCl, MgSO4, NaNO3 là muối
Đáp án C
Câu 14: Dung dịch acid thường có giá trị pH là:
A.pH > 7 B. pH 14
Hướng dẫn:
Dung dịch acid thường có giá trị pH < 7
Lời giải:
Đáp án B
Câu 15: Chất nào sau đây trong phân lân, cung cấp nguyên tố đa lượng cho cây trồng?
A. MgCl2. B. Na2CO3. C. Ca(H2PO4)2. D. CaSO4.
Lời giải:
Đáp án C
II. Tự luận
Câu 1: Hoàn thành sơ đồ phản ứng sau:
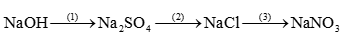
Lời giải:
\(\begin{array}{l}(1)2NaOH + {H_2}S{O_4} \to N{a_2}S{O_4} + 2{H_2}O\\(2)N{a_2}S{O_4} + BaC{l_2} \to BaS{O_4} + 2NaCl\\(3)NaCl + AgN{O_3} \to NaN{O_3} + AgN{O_3}\end{array}\)
Câu 2: Cho một thanh sắt (Fe) vào cốc đựng 200 mL dung dịch CuSO4 nồng độ a (M). Sau khi phản ứng hoàn toàn, đồng sinh ra bám hết vào thanh sắt. Cân lại thanh sắt thấy khối lượng tăng thêm 0,8 g. Xác định giá trị của a.
Hướng dẫn:
Dựa vào khái niệm tính chất vật lí, tính chất hóa học của muối
Lời giải:
Fe + CuSO4 → FeSO4 + Cu
Số mol Fe phản ứng = số mol CuSO4 = 0,2a mol = số mol Cu tạo thành.
⇒⇒Khối lượng tăng thêm = khối lượng Cu – khối lượng Fe.
= 64. 0,2a – 56. 0,2a = 0,8 (g).
Vậy a = 0,5.