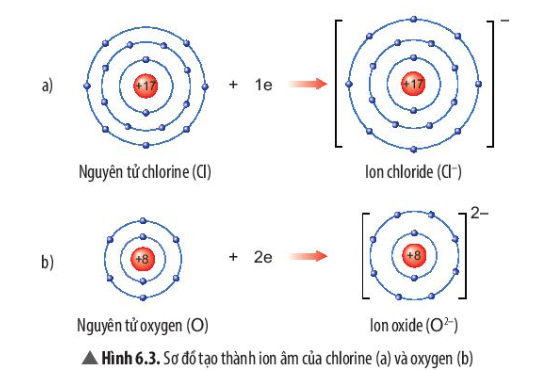
Hướng dẫn giải Câu hỏi trang 38 Bài 6. Giới thiệu về liên kết hóa học SGK Khoa học tự nhiên 7 Chân trời sáng tạo. Tham khảo: Nguyên tử Cl nhận thêm 1 electron ở lớp ngoài cùng.
Câu hỏi/Đề bài:
|
Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào? |
Hướng dẫn:
– Nguyên tử Cl nhận thêm 1 electron ở lớp ngoài cùng
– Nguyên tử Mg nhận thêm 2 electron ở lớp ngoài cùng
Lời giải:
– Sự tạo thành ion chloride: Nguyên tử chlorine (Cl) nhận thêm 1 electron ở lớp ngoài cùng để tạo thành ion âm Cl–
– Sự tạo thành ion oxide: Nguyên tử oxygen (O) nhận thêm 2 electron ở lớp ngoài cùng để tạo thành ion âm O2-
– Sau khi nhận electron, ion chloride có 3 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)
– Sau khi nhận electron, ion oxide có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Giống sự phân bố electron của nguyên tử Argon (Ar)