Trả lời Câu 6.25 Bài 6. Một số hợp chất oxygen của nitrogen (trang 22, 23, 24, 25) – SBT Hóa 11 Kết nối tri thức. Gợi ý: Phương pháp giải.
Câu hỏi/Đề bài:
Trong công nghiệp, nitric acid được sản xuất theo 3 giai đoạn của quá trình Ostwald.
Giai đoạn 1: Oxi hoá NH3 thành NO.
Nung nóng hỗn hợp gồm 1 phần thể tích ammonia và 9 phần thể tích không khí tới nhiệt độ khoảng 900 °C (xúc tác Pt-Rh): 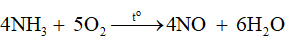
Giai đoạn 2: Oxi hoá NO thành NO2.
Dẫn hỗn hợp khi sau giai đoạn 1 qua hệ thống làm mát để hạ nhiệt độ: \({\rm{2NO }} + {\rm{ }}{{\rm{O}}_{\rm{2}}} \to {\rm{ 2N}}{{\rm{O}}_{\rm{2}}}\)
Giai đoạn 3: Tổng hợp nitric acid.
\({\rm{3N}}{{\rm{O}}_{\rm{2}}} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O}} \to {\rm{ 2HN}}{{\rm{O}}_{\rm{3}}} + {\rm{ NO}}\)
Khí NO sinh ra ở giai đoạn 3 được dẫn quay về giai đoạn 2 của chu trình sản xuất.
a) Xác định chất khử, chất oxi hoá trong 3 giai đoạn sản xuất trên.
b) Tại sao ban đầu cần trộn ammonia với không khí theo tỉ lệ thể tích 1: 9? (Biết không khí chứa 21% thể tích oxygen.)
Hướng dẫn:
Hướng dẫn:
a) Trong phản ứng oxi hóa khử:
+ Chất khử là chất nhường electron, có số oxi hóa tăng sau phản ứng.
+ Chất oxi hóa là chất nhận electron, có số oxi hóa giảm sau phản ứng.
b) Viết và tìm hệ số phương trình tổ hợp chung của 3 giai đoạn (sao cho chất phản ứng chỉ còn chất phản ứng gồm NH3 và O2) để tìm tỉ lệ hệ số tỉ lượng giữa NH3 và O2, từ đó suy ra được tỉ lệ giữa NH3 và không khí.
Lời giải:
