Đáp án Câu 19.26 Bài 19. Carboxylic acid (trang 96, 97, 98, 99, 100, 101) – SBT Hóa 11 Chân trời sáng tạo. Tham khảo: Acid carboxylic làm quỳ tím hóa đỏ, phản ứng với Na2CO3 tạo khí CO2.
Câu hỏi/Đề bài:
Hợp chất hữu cơ (X) có công thức phân tử là C4H6O2 nhưng chưa rõ công thức cấu tạo. Để tiến hành xác định công thức cấu tạo của chất, người ta đã thực nghiệm về tính chất của (X) thu được kết quả sau:
− (X) làm quỳ tím chuyển màu đỏ;
− (X) làm mất màu nước bromine;
– Khi cho tác dụng với Na2CO3 tạo chất khí không màu.
a) Tìm công thức cấu tạo có thể có của (X), gọi tên các đồng phân và cho biết cấu tạo nào có đồng phân hình học.
b) Viết phương trình hoá học của các phản ứng xảy ra.
Hướng dẫn:
a) – Acid carboxylic làm quỳ tím hóa đỏ, phản ứng với Na2CO3 tạo khí CO2.
Acid carboxylic làm mất màu nước bromine, chứng tỏ có liên kết bội trong phân tử.
– Tên theo danh pháp thay thế của carboxylic acid đơn chức, mạch hở:
Số chỉ vị trí nhánh-Tên nhánh +Tên hydrocarbon ứng với mạch chính (bỏ kí tự e ở cuối) + oic + acid
Nhánh -OH gọi tên là hydroxy.
b) Phản ứng với cộng Br2 tại vị trí liên kết bội.
Phản ứng với Na2CO3 tại nhóm chức -COOH.
Lời giải:
a) (X) làm mất màu nước bromine nên (X) có chứa liên kết đôi trong phân tử. (X) làm quỳ tím chuyển màu đỏ, tạo chất khí không màu khi tác dụng với Na2CO3, vậy (X) là carboxylic acid.
Với công thức phân tử là C4H6O2 chứa liên kết đôi và mang nhóm chức carboxylic acid, các đồng phân có thể có của (X) là:
CH2=CH-CH-COOH (but-1-enoic acid)
CH3CH=CH-COOH (but-2-enoic acid)
CH2=C(CH3)-COOH (2-methylprop-2-enoic acid)
Trong đó but-2-enoic acid có đồng phân hình học (cis-, trans-):
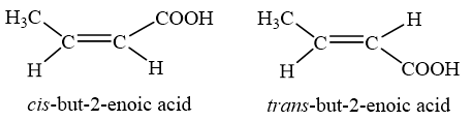
b) Các phương trình phản ứng:
CH2=CH-CH-COOH (but-1-enoic acid)
\(\begin{array}{l}{\rm{C}}{{\rm{H}}_{\rm{2}}} = {\rm{CH}} – {\rm{CH}} – {\rm{COOH + B}}{{\rm{r}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{Br}} – {\rm{CHBr}} – {\rm{CH}} – {\rm{COOH}}\\{\rm{2C}}{{\rm{H}}_{\rm{2}}} = {\rm{CH}} – {\rm{CH}} – {\rm{COOH + N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to 2{\rm{C}}{{\rm{H}}_{\rm{2}}} = {\rm{CH}} – {\rm{CH}} – {\rm{COONa + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}} \uparrow \end{array}\)
CH3CH=CH-COOH (but-2-enoic acid)
\(\begin{array}{l}{\rm{C}}{{\rm{H}}_3} – {\rm{CH}} = {\rm{CH}} – {\rm{COOH + B}}{{\rm{r}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{3}}} – {\rm{CHBr}} – {\rm{CHBr}} – {\rm{COOH}}\\{\rm{2C}}{{\rm{H}}_3} – {\rm{CH}} = {\rm{CH}} – {\rm{COOH + N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to 2{\rm{C}}{{\rm{H}}_3} – {\rm{CH}} = {\rm{CH}} – {\rm{COONa + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}} \uparrow \end{array}\)
CH2=C(CH)-COOH (2-methylprop-2-enoic acid)
\(\begin{array}{l}{\rm{C}}{{\rm{H}}_{\rm{2}}} = {\rm{C}}\left( {{\rm{C}}{{\rm{H}}_3}} \right) – {\rm{COOH + B}}{{\rm{r}}_{\rm{2}}} \to {\rm{C}}{{\rm{H}}_{\rm{2}}}{\rm{Br}} – {\rm{CBr}}\left( {{\rm{C}}{{\rm{H}}_3}} \right) – {\rm{COOH}}\\{\rm{2C}}{{\rm{H}}_{\rm{2}}} = {\rm{C}}\left( {{\rm{CH}}} \right) – {\rm{COOH + N}}{{\rm{a}}_{\rm{2}}}{\rm{C}}{{\rm{O}}_{\rm{3}}} \to 2{\rm{C}}{{\rm{H}}_{\rm{2}}} = {\rm{C}}\left( {{\rm{CH}}} \right) – {\rm{COONa + }}{{\rm{H}}_{\rm{2}}}{\rm{O + C}}{{\rm{O}}_{\rm{2}}} \uparrow \end{array}\)