Đáp án Câu 18.14 Bài 18. Hợp chất carbonyl (aldehyde – ketone) (trang 91, 92, 93, 94) – SBT Hóa 11 Chân trời sáng tạo. Tham khảo: Hợp chất aldehyde bị khử bởi hydrogen ở vị trí có các liên kết π.
Câu hỏi/Đề bài:
Cho hỗn hợp (X) gồm 0,1 mol propenal và khí hydrogen qua ống sứ nung nóng có chứa Ni làm xúc tác, thu được hỗn hợp (Y) gồm propanal, propan-1-ol, propenal và 0,15 mol khí hydrogen.
a) Viết các phản ứng hoá học xảy ra.
b) Tính số mol khí hydrogen trong hỗn hợp (X) ban đầu, biết tỉ khối hơi của hỗn hợp (Y) so với CH4 bằng 1,55.
Hướng dẫn:
a) Hợp chất aldehyde bị khử bởi hydrogen ở vị trí có các liên kết π.
b) Tính số mol của (Y) và khối lượng của (Y).
Tính khối lượng H2 trong (X) rồi suy ra số mol H2 trong (X).
Lời giải:
a) Hỗn hợp (Y) gồm propanal, propan-1-ol, propenal và hydrogen.
Các phản ứng hóa học xảy ra:
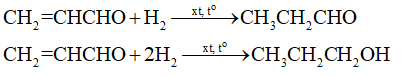
b) Ta có: \({{\rm{n}}_{{\rm{propanal}}}} + {{\rm{n}}_{{\rm{propan – 1 – ol}}}} + {{\rm{n}}_{{\rm{propenal}}}} = {{\rm{n}}_{{\rm{propenal/X}}}} = 0,1{\rm{ (mol)}}\)
\(\begin{array}{l} \Rightarrow {{\rm{n}}_{\rm{Y}}} = {{\rm{n}}_{{\rm{propanal}}}} + {{\rm{n}}_{{\rm{propan – 1 – ol}}}} + {{\rm{n}}_{{\rm{propenal}}}} + {{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}}\\{\rm{ = 0,1 + 0,15 = 0,15 (mol)}}\end{array}\)
Vì \({{\rm{d}}_{{\raise0.7ex\hbox{${\rm{Y}}$} \!\mathord{\left/
{\vphantom {{\rm{Y}} {{\rm{C}}{{\rm{H}}_{\rm{4}}}}}}\right.\kern-\nulldelimiterspace}
\!\lower0.7ex\hbox{${{\rm{C}}{{\rm{H}}_{\rm{4}}}}$}}}} = 1,55 \Leftrightarrow \frac{{{{\rm{M}}_{\rm{Y}}}}}{{{{\rm{M}}_{{\rm{C}}{{\rm{H}}_{\rm{4}}}}}}} = 1,55 \Rightarrow {{\rm{M}}_{\rm{Y}}} = 1,55 \times 16 = 24,8{\rm{ (g)}}\)
\( \Rightarrow {{\rm{m}}_{\rm{Y}}} = 0,25 \times 24,8 = 6,2{\rm{ (g)}}\)
Bảo toàn khối lượng, ta có khối lượng hỗn hợp trước và sau phản ứng bằng nhau nên: \({{\rm{m}}_{\rm{X}}}{\rm{ = }}{{\rm{m}}_{\rm{Y}}} = 6,2{\rm{ (g)}}\)
Mặt khác: \({{\rm{m}}_{\rm{X}}}{\rm{ = }}{{\rm{m}}_{{\rm{propenal}}}} + {{\rm{m}}_{{{\rm{H}}_{\rm{2}}}}}\)
\(\begin{array}{l} \Rightarrow {{\rm{m}}_{{{\rm{H}}_{\rm{2}}}}} = {{\rm{m}}_{\rm{X}}} – {\rm{ }}{{\rm{m}}_{{\rm{propenal}}}} = 6,2 – 0,1 \times 56 = 0,6{\rm{ (g)}}\\ \Rightarrow {{\rm{n}}_{{{\rm{H}}_{\rm{2}}}{\rm{/X}}}} = \frac{{0,6}}{2} = 0,3{\rm{ (mol)}}\end{array}\)