Giải Câu 12.18 Bài 12. Alkane (trang 51, 52, 53, 54, 55) – SBT Hóa 11 Chân trời sáng tạo. Tham khảo: Có thể dự đoán phân tử khối của hợp chất hữu cơ đơn giản bằng tín hiệu của mảnh.
Câu hỏi/Đề bài:
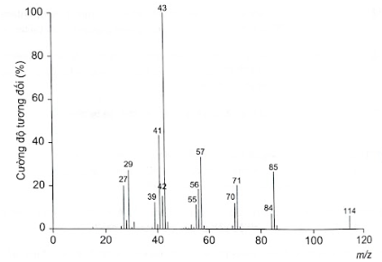
Phân tích thành phần nguyên tố của hợp chất hữu cơ (X) thu được kết quả %C và %H (theo khối lượng) lần lượt là 84,21% và 15,79%. Phân tử khối của hợp chất (X) này được xác định thông qua kết quả phổ khối lượng) như hình bên dưới với peak ion phân tử có giá trị m/z lớn nhất.
a) Xác định công thức phân tử của (X).
b) Nếu không có kết quả phân tích phổ khối lượng của (X), trình bày cách xác định công thức phân tử của (X) dựa trên những dữ kiện em đã biết.
Hướng dẫn:
a) Có thể dự đoán phân tử khối của hợp chất hữu cơ đơn giản bằng tín hiệu của mảnh ion phân tử (kí hiệu là [M+]). Mảnh ion phân tử này thường ứng với tín hiệu có giá trị m/z lớn nhất.
Thiết lập công thức phân tử hợp chất hữu cơ (CxHyOzNt) từ dữ liệu phân tích nguyên tố và phân tử khối (M) được khái quát như sau:
\[{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; z = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{O}}}}}{{{\rm{16}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{; t = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{N}}}}}{{{\rm{14}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}\]
Với x, y, z, t lần lượt là số nguyên tử C, số nguyên tử H, số nguyên tử O, số nguyên tử N; %mC, %mH, %mO, %mN lần lượt là % khối lượng của các nguyên tố C, H, O, N trong hợp chất hữu cơ.
b) Tìm công thức đơn giản nhất của (X) và kết hợp với điều kiện sau:
Trong hợp chất CxHyOz bất kì, ta có: \[{\rm{y}} \le 2{\rm{x}} + 2\]
Lưu ý: Số H trong hợp chất hydrocarbon (hoặc hợp chất chứa C, H, O) luôn luôn là số chẵn
Lời giải:
a) Vì \[\% {{\rm{m}}_{\rm{H}}} + \% {{\rm{m}}_{\rm{C}}} = {\rm{ 15,79\% + 84,21\% = }}100\% \] nên phân tử (X) chỉ chứa nguyên tố hydrogen và carbon.
Gọi công thức phân tử của (X) là CxHy.
Khối lượng mol phân tử của (X) được xác định trên phổ khối lượng tương ứng với peak có giá trị m/z lớn nhất. Do đó, từ phổ khối lượng của (X), ta có: \[{{\rm{M}}_{\left( X \right)}} = 114\]
\[\begin{array}{l}{\rm{x = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{C}}}}}{{{\rm{12}}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{84,21}}{{{\rm{12}}}} \times \frac{{114}}{{{\rm{100}}}} \approx 8\\{\rm{y = }}\frac{{{\rm{\% }}{{\rm{m}}_{\rm{H}}}}}{{\rm{1}}} \times \frac{{\rm{M}}}{{{\rm{100}}}}{\rm{ = }}\frac{{15,79}}{{\rm{1}}} \times \frac{{114}}{{{\rm{100}}}} \approx 18\end{array}\]
Vậy công thức phân tử của (X) là C8H18.
b) Vì \[\% {{\rm{m}}_{\rm{H}}} + \% {{\rm{m}}_{\rm{C}}} = {\rm{ 15,79\% + 84,21\% = }}100\% \] nên phân tử (X) chỉ chứa nguyên tố hydrogen và carbon.
Gọi công thức đơn giản nhất của (X) là CxHy.
\[\begin{array}{l}{\rm{x}}:{\rm{y}} = \frac{{\% {\rm{C}}}}{{12}}:\frac{{\% {\mathop{\rm H}\nolimits} }}{1} = \frac{{84,21}}{{12}}:\frac{{15,79}}{1}\\{\rm{ = 7,0175}}:15,79 \approx 4:9\end{array}\]
\[ \Rightarrow \] Công thức đơn giản nhất của (X) là (C4H9)n hay C4nH9n.
Vì trong hợp chất CxHyOz bất kì, ta có: \[{\rm{y}} \le 2{\rm{x}} + 2 \Leftrightarrow 4{\rm{n}} \le 2 \times 4{\rm{n}} + 2 \Rightarrow {\rm{n}} \le 2\]
+) Với \[{\rm{n}} = 1\], công thức phân tử của (X) là C4H9 \[ \Rightarrow \]Loại trường hợp này vì số H trong hợp chất hydrocarbon luôn luôn là số chẵn.
+) Với \[{\rm{n}} = 2\], công thức phân tử của (X) là C8H18 (nhận).
Vậy công thức phân tử của (X) là C8H18.