Hướng dẫn giải Đề cương ôn tập học kì 1 Hóa 11 – Đề thi học kì 1 – Đề thi đề kiểm tra Hóa lớp 11 Kết nối tri thức. Chủ đề 1: Cân bằng hóa học – Định nghĩa: phản ứng thuận nghịch, trạng thái cân bằng,…
A. NỘI DUNG ÔN TẬP
Chủ đề 1: Cân bằng hóa học
– Định nghĩa: phản ứng thuận nghịch, trạng thái cân bằng, sự điện li, chất điện li, chất không điện li, thuyết Bronsted – Lowry về acid – base, thang pH và ý nghĩa của pH
– Viết được biểu thức hằng số cân bằng KC của phản ứng thuận nghịch
– Vận dụng được nguyên lí chuyển dịch cân bằng Le Chatelier để giải thích ảnh hưởng của nhiệt độ, nồng độ, áp suất đến cân bằng hóa học
– Xác định pH của dung dịch từ công thức tính
– Chuẩn độ acid – base
Chủ đề 2: Nitrogen và sulfur
- Đơn chất nitrogen
– Trạng thái tự nhiên, cấu tạo, tính chất vật lí của nitrogen
– Tính chất hóa học của nitrogen
– Ứng dụng của nitrogen trong sản xuất, nghiên cứu
- Hợp chất của nitrogen
– Mô tả được công thức Lewis và dạng hình học của phân tử ammonia
– Tính chất vật lí, tính chất hóa học của ammonia
– Tính chất hóa học của muối ammonium
– Ứng dụng của ammonia và muối ammonium
– Mô tả được cấu tạo của HNO3
– Tính chất vật lí, tính chất hóa học của HNO3
- Đơn chất sulfur
– Trạng thái tự nhiên, cấu tạo, tính chất vật lí của sulfur
– Tính chất hóa học của sulfur
– Ứng dụng của sulfur trong sản xuất
- Hợp chất của sulfur
– Cấu tạo của H2SO4
– Tính chất hóa học của SO2, H2SO4, SO42-
– Ứng dụng của H2SO4, SO42-
- Một số hiện tượng gây ra bởi nitrogen và sulfur
– Giải thích được hiện tượng mưa acid
– Giải thích được hiện tượng phú dưỡng
Chủ đề 3: Đại cương về hóa học hữu cơ
– Khái niệm hợp chất hữu cơ, hóa học hữu cơ, nhóm chức, công thức phân tử hợp chất hữu cơ, thuyết cấu tạo hóa học trong hóa học hữu cơ, chất đồng đẳng, đồng phân
– Phân loại được hợp chất hữu cơ
– Nhận biết một số loại nhóm chức bằng phổ IR, xác định được công thức phân tử từ phổ MS
– Các nguyên tắc và cách tiến hành các phương pháp tách biệt và tinh chế hợp chất hữu cơ
– Lập được công thức phân tử hữu cơ từ dữ liệu phân tích nguyên tố
– Viết được công thức cấu tạo của một số hợp chất hữu cơ đơn giản
B. BÀI TẬP
Đề bài/câu hỏi:
I. Trắc nghiệm
Câu 1. Phản ứng thuận nghịch là phản ứng
A. phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
B. có phương trình hoá học được biểu diễn bằng mũi tên một chiều.
C. chỉ xảy ra theo một chiều nhất định.
D. xảy ra giữa hai chất khí.
Câu 2. Phản ứng nào sau đây là phản ứng thuận nghịch?

Câu 3. Cho phản ứng hoá học sau: H2(g) + Br2(g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2HBr(g)
Biểu thức hằng số cân bằng (KC) của phản ứng trên là
A. \({{\rm{K}}_{\rm{C}}} = \frac{{2[{\rm{HBr}}]}}{{\left[ {{\rm{B}}{{\rm{r}}_2}} \right]\left[ {{{\rm{H}}_2}} \right]}}\).
B. \({{\rm{K}}_{\rm{C}}} = \frac{{{{[{\rm{HBr}}]}^2}}}{{\left[ {{{\rm{H}}_2}} \right]\left[ {{\rm{B}}{{\rm{r}}_2}} \right]}}\).
C. \({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{{\rm{H}}_2}} \right]\left[ {{\rm{B}}{{\rm{r}}_2}} \right]}}{{{{[{\rm{HBr}}]}^2}}}\).
D. \({{\rm{K}}_{\rm{C}}} = \frac{{\left[ {{{\rm{H}}_2}} \right]\left[ {{\rm{B}}{{\rm{r}}_2}} \right]}}{{2[{\rm{HBr}}]}}\).
Câu 4. Các yếu tố có thể ảnh hưởng đến cân bằng hoá học là
A. nồng độ, nhiệt độ và chất xúc tác. B. nồng độ, áp suất và diện tích bề mặt.
C. nồng độ, nhiệt độ và áp suất. D. áp suất, nhiệt độ và chất xúc tác.
Câu 5. Cho các phản ứng hoá học sau:

(a) Các phản ứng toả nhiệt là
A. (1); (2) và (3). B. (1) và (3).
C. (1); (2); (4) và (5) D. (1); (2); (3) và (5).
(b) Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (2) và (5). C. (4) và (5). D. (3) và (5).
(c) Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3). B. (1); (3) và . C. (2); (3) và (4). D. (3); (4) và (5).
Câu 6. Cho phản ứng: H2 (g) + I2 (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) 2HI (g)
Ở nhiệt độ 4300C, hằng số cân bằng KC của phản ứng trên bằng 53,96. Đun nóng một bình kín dung tích không đổi 10 lít chứa 4,0 gam H2 và 406,4 gam I2. Khi hệ phản ứng đạt trạng thái cân bằng ở 4300C, nồng độ của HI là
A. 0,275M. B. 0,320M. C. 0,225M. D. 0,151M.
Câu 7. Phát biểu nào sau đây đúng khi nói về sự điên li?
A. Sự điện li là quá trình phân li một chất trong nước thành ion.
B. Sự điện li quá trình hòa tan một chất vào nước tạo thành dung dịch.
C. Sự điện li quá trình phân li một chất dưới tác dụng của dòng điện.
D. Sự điện li thực chất là quá trình oxi hóa – khử.
Câu 8. Chất nào sau đây là chất điện li?
A. Cl2. B. HNO3. C. MgO. D. CH4.
Câu 9. Chất nào sau đây không phải chất điện li?
A. KOH. B. H2S. C. HNO3. D. C2H5OH.
Câu 10. Chất nào sau đây thuộc loại chất điện li mạnh?
A. CH3COOH. B. C2H5OH. C. H2O. D. NaCl.
Câu 11. Chất nào sau đây thuộc loại chất điện li yếu?
A. KCl. B. HF. C. HNO3. D. NH4Cl.
Câu 12. Cho phương trình: CH3COOH + H2O \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) CH3COO– + H3O+
Trong phản ứng nghịch, theo thuyết Bronsted – Lowry chất nào là base?
A. CH3COOH. B. H2O. C. CH3COO–. D. H3O+.
Câu 13. Dung dịch chất nào sau đây có pH > 7?
A. NaNO3. B. KCl. C. H2SO4. D. KOH.
Câu 14. Dung dịch nào sau đây có pH < 7?
A. BaCl2. B. KOH. C. HNO3. D. Na2SO4.
Câu 15. Dung dịch nào sau đây có pH = 7?
A. NaCl. B. NaOH. C. HNO3. D. H2SO4.
Câu 16. Giá trị pH của dung dịch NaOH 0,1 M là
A. 1. B. 13. C. 11. D. 3.
Câu 17. Trộn 250 mL dung dịch hỗn hợp HCl 0,08 M và H2SO4 0,01 M với 250 mL dung dịch Ba(OH)2 có nồng độ x M, thu được m gam kết tủa và 500 mL dung dịch có pH = 12. Giá trị của m và x là
A. 0,5825 và 0,06. B. 0,5565 và 0,06.
C. 0,5825 và 0,03. D. 0,5565 và 0,03.
Câu 18. Để xác định nồng độ của một dung dịch NaOH, người ta đã tiến hành chuẩn độ bằng dung dịch HCl 0,1 M. Để chuẩn độ 10 mL dung dịch NaOH này cần 12 mL dung dịch HCl. Nồng độ của dung dịch NaOH trên là
A. 0,1. B. 1,2. C. 0,12. D. 0,012.
Câu 19. Ở dạng hợp chất, nitrogen tồn tại nhiều trong các mỏ khoáng dưới dạng
A. NaNO3. B. KNO3. C. HNO3. D. Ba(NO3)2.
Câu 20. Trong phản ứng: N2(g) + 3H2(g)  2NH3(g). N2 thể hiện
2NH3(g). N2 thể hiện
A. tính khử. B. tính oxi hóa. C. tính base. D. tính acid.
Câu 21. Khi có sấm chớp, khí quyển sinh ra khí
A. CO B. NO. C. SO2. D. CO2.
Câu 22. Quá trình tạo đạm nitrate từ nitrogen trong tự nhiên được mô tả theo sơ đồ sau:

Công thức của X là
A. Cl2. B. O2. C. H2. D. CO2.
Câu 23. Trong ammonia, nitrogen có số oxi hóa là
A. +3. B. -3. C. +4. D. +5.
Câu 24. Để tạo độ xốp cho một số loại bánh, có thể dùng muối nào sau đây làm bột nở?
A. (NH4)2SO4. B. NH4HCO3. C. CaCO3. D. NH4NO2.
Câu 25. Để pha loãng dung dịch H2SO4 đặc, người ta dùng cách nào sau đây?
A. Rót nhanh dung dịch H2SO4 đặc vào nước.
B. Rót từ từ nước vào dung dịch H2SO4 đặc.
C. Rót từ từ dung dịch H2SO4 đặc vào nước, khuấy đều.
D. Rót nhanh nước vào H2SO4 đặc, đun nóng.
Câu 26. Nhóm kim loại nào sau đây không tác dụng với H2SO4 loãng?
A. Zn, Al. B. Na, Mg. C. Cu, Hg. D. Mg, Fe.
Câu 27. Tính chất nào sau đây không phải tính chất của dung dịch sulfuric acid đặc?
A. Tính háo nước. B. Tính oxi hóa. C. Tính acid. D. Tính khử.
Câu 28. Cho thí nghiệm như hình vẽ, bên trong bình có chứa khí NH3, trong chậu thủy tinh chứa nước có nhỏ vài giọt phenolphthalein.

Hiện tượng xảy ra trong thí nghiệm là:
A. Nước phun vào bình và chuyển thành màu hồng.
B. Nước phun vào bình và chuyển thành màu tím.
C. Nước phun vào bình và không có màu.
D. Nước phun vào bình và chuyển thành màu xanh.
Câu 29. Mưa acid là hiện tượng tượng nước mưa có pH như thế nào?
A. > 5,6. B. < 7. C. > 7. D. < 5,6.
Câu 30. Phú dưỡng là hiện tượng dư thừa quá nhiều các nguyên tố dinh dưỡng nào trong các nguồn nước?
A. N, C. B. N, K. C. N, P. D. P, K.
Câu 31. Hoạt động nào sau đây góp phần gây nên hiện tượng phú dưỡng?
A. Sự quang hợp của cây xanh.
B. Nước thải sinh hoạt thải trực tiếp vào nguồn nước chưa qua xử lí.
C. Ao hồ thả quá nhiều tôm, cá.
D. Khử trùng ao hồ sau khi tát cạn bằng vôi sống (CaO).
Câu 32. Sulfur trong chất nào sau đây vừa có tính oxi hóa, vừa có tính khử?
A. H2S. B. Na2SO4. C. SO2. D. H2SO4.
Câu 33. SO2 là một khí độc được thải ra từ các vùng công nghiệp, là một trong những nguyên nhân chính gây ra hiện tượng nào dưới đây?
A. Mưa acid. B. Hiệu ứng nhà kính.
C. Hiệu ứng đomino. D. Sương mù.
Câu 34. Cho cân bằng hoá học: N2(g) + 3H2(g)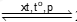 2NH3(g). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
2NH3(g). Phản ứng thuận là phản ứng toả nhiệt. Cân bằng hoá học không bị chuyển dịch khi
A. thay đổi áp suất của hệ. B. thay đổi nồng độ N2.
C. thay đổi nhiệt độ. D. thêm chất xúc tác Fe.
Câu 35. Cho sơ đồ phản ứng sau:
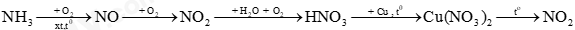
Mỗi mũi tên là một phản ứng hóa học. Số phản ứng mà nitrogen đóng vai trò chất khử là
A. 2. B. 3. C. 4. D. 5.
Câu 36. Cho các phát biểu sau:
(a) Sulfur là chất rắn, màu trắng, không tan trong nước.
(b) Sulfur và sulfur dioxide vừa có tính oxi hóa, vừa có tính khử.
(c) Khi phản ứng với hydrogen, sulfur thể hiện tính oxi hóa
(d) Nước thải sinh hoạt là một trong các nguồn phát thải khí SO2.
(e) Sulfur dioxide được sử dụng để tẩy trắng vải sợi, bột giấy, sản xuất sulfuric acid và diệt nấm mốc.
Số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 37. Hòa tan m gam FeO bằng dung dịch HNO3 dư thu được 6,1975 lít hỗn hợp khí X gồm NO, N2O (đkc) (biết tỉ khối X so với H2 bằng 19,2). Giá trị m là
A. 72. B. 86,4. C. 108. D. 144.
Câu 38: Định nghĩa đúng về hợp chất hữu cơ là:
A. Là hợp chất của carbon ( bao gồm một số hợp chất như carbon monoxide, carbon dioxide, muối carbonate, cyanide, carbide,…).
B. Thường là hợp chất của carbon với các nguyên tố phi kim khác như oxygen, hydrogen, nitrogen,…
C. Là hợp chất của carbon (trừ một số hợp chất như carbon monoxide, carbon dioxide, muối carbonate, cyanide, carbide,…).
D. Là hợp chất của carbon với các nguyên tố kim loại.
Câu 39: Đặc điểm chung của các phân tử hợp chất hữu cơ là
1) thường chứa nguyên tố C
2) có thể chứa nguyên tố khác như Cl, N, P, O.
3) liên kết hóa học chủ yếu là liên kết cộng hoá trị.
4) liên kết hoá học chủ yếu là liên kết ion.
5) khó bay hơi, khó cháy.
6) phản ứng hoá học xảy ra nhanh.
7) nhiệt độ nóng chảy, nhiệt độ sôi thấp
Số phát biểu đúng là:
A. 4, 5, 6, 7. B. 2, 3,7. C. 1,2, 3, 6. D. 1,2,3,7.
Câu 40: Acetone dùng để tẩy sơn móng tay. Cơ sở của việc làm này là gì?
A. Chất hữu cơ dễ bị hòa tan trong các chất lỏng
B. Xảy ra phản ứng hóa học giữa acetone và sơn móng tay
C. Acetone tiếp xúc với sơn móng tay quá trình này tỏa nhiệt và làm sơn móng tay bay hơi.
D. Phần lớn các chất hữu cơ không tan trong nước, nhưng tan nhiều trong các dung môi hữu cơ như (benzene, xăng, carbon tetrachloride, acetone,…)
Câu 41: Nhóm các hợp chất nào sau đây đều thuộc dẫn xuất hydrocarbon
A. Alcohol và carbonic acid
B. Dẫn xuất halogen và carboxylic acid
C. Alcohol và muối
D. Carboxylic acid và carbonate
Câu 42: Nguyên tử hay nhóm nguyên tử gây ra tính chất hóa học đặc trưng của hợp chất hữu cơ được gọi là
A. Nhóm định hướng
B. Nhóm hóa trị
C. Nhóm hoạt động hóa học
D. Nhóm chức
Câu 43: Hình ảnh phổ IR của các chất cần xác định công thức cấu tạo được đánh kí hiệu I, II ở hình dưới đây
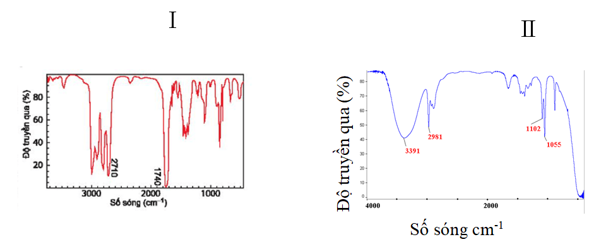
Biết rằng hai chất trên có công thức phân tử C2H6O và C3H6O. Công thức cấu tạo đúng lần lượt của các chất I, II là:
A. CH3-O-CH3, CH2=CH-CH2-OH
B. CH3-CO-CH3, CH3-O-CH3
C. CH3-CH2-CHO, CH3-O-CH3
D. CH3-CH2-CHO, CH3-CH2-OH
Câu 44: Từ xa xưa người ta đã biết cách thu muối ăn từ nước biển bằng cách dẫn nước biển vào khu vực là những khoảnh đất thấp và phẳng được chuẩn bị sẵn gọi là ruộng muối, sử dụng sức nóng của mặt trời để làm nước bay hơi thu được muối rắn. Phương pháp này được gọi là:
A. Lôi cuốn hơi nước
B. Chiết
C. Kết tinh
D. Lắng đọng
Câu 45: Bộ dụng cụ chiết (được mô tả như hình vẽ bên) dùng để

A. Tách hai chất rắn tan trong dung dịch. B. Tách hai chất lỏng tan tốt vào nhau.
C. Tách hai chất lỏng không tan vào nhau. D. Tách chất lỏng và chất rắn.
Câu 46: Công thức phân tử cho biết điều gì. Em hãy chọn phương án đúng nhất trong các phương án sau đây:
A. Thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố trong phân tử.
B. Tỉ lệ số nguyên tử mỗi nguyên tố trong phân tử.
C. Tỉ lệ số nguyên tử mỗi nguyên tố và tỉ lệ khối lượng của các nguyên tử mỗi nguyên tố trong phân tử.
D. Thành phần nguyên tố, số lượng nguyên tử của mỗi nguyên tố và sự liên kết giữa các nguyên tử trong phân tử.
Câu 47: Khác với công thức phân tử là công thức đơn giản nhất không cho biết điều nào sau đây:
A. Tỉ lệ giữa nguyên tử các nguyên tố trong phân tử
B. Thành phần nguyên tố trong phân tử
C. Tỉ lệ khối lượng nguyên tử mỗi nguyên tố trong phân tử
D. Khối lượng phân tử
Câu 48: Chất X có công thức phân tử C6H10O4. Công thức nào sau đây là công thức đơn giản nhất của X?
A. C3H5O2. B. C6H10O4. C. C3H10O2. D. C12H20O8.
Câu 49: Công thức cấu tạo (thu gọn) có thể có của các chất được đánh kí hiệu A, B, C có phổ khối lượng (MS) có peak ion phân tử [M+] được thể hiện trong hình dưới đây

lần lượt là:
A. CH3-CH2-OH; CH3-CH2-CH2-CH3, CH3-CH(CH3)-CH3
B. CH3-CH2-CH2-CH3, CH3-CH(CH3)-CH3; CH3-CH2-OH
C. CH3-CH(CH3)-CH3; CH3-CH2-CH2-CH3; CH3-CH2-OH
D. CH3-CH(CH3)-CH3; CH3-CH2-OH; CH3-CH2-CH2-CH3
Câu 50: Ứng với công thức phân tử C5H11Cl có bao nhiêu đồng phân cấu tạo
A. 9 B. 10 C. 5 D. 8
II. Tự luận
Câu 1: Phản ứng: \({\rm{COC}}{{\rm{l}}_{\rm{2}}}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{CO}}(g) + {\rm{C}}{{\rm{l}}_{\rm{2}}}(g){\rm{ }}\) đạt trạng thái cân bằng ở 900 K.
Hằng số cân bằng của phản ứng có giá trị là 8,2×10-2. Giả sử nồng độ mol ở trạng thái cân bằng của CO và Cl2 là 0,150M. Tính nồng độ mol ở trạng thái cân bằng của COCl2.
Câu 2: Cho cân bằng hoá học sau: \(CO\left( g \right) + {H_2}O\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2}\left( g \right) + C{O_2}\left( g \right)\)
Ở 700 °C, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 700 °C. Tính nồng độ các chất ở trạng thái cân bằng.
Câu 3: Cho các chất: HCl, Na2SO4, HF, CH3COOH, C2H5OH, CH4, Ba(OH)2, HClO.
(a) Phân loại các chất trên thành chất điện li mạnh, chất điện li yếu và chất không điện li.
(b) Viết phương trình điện li của các chất điện li.
Câu 4: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng
đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo được giá trị pH là 4,52.
(a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
(b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp giảm độ chua, tăng độ pH của đất.
Câu 5: Một học sinh thực hiện thí nghiệm sau: Lấy 10ml dung dịch HCl 0,2M cho vào 5ml dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1M thấy phản ứng hết 10,2ml. Tính nồng độ NH3 ban đầu.
Câu 6: Cho hỗn hợp gồm N2, H2, NH3 đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần % theo thể tích của NH3 trong hỗn hợp đầu là bao nhiêu?
Câu 7: Hydrogen sulfide phân hủy theo phản ứng sau đây:
2H2S (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2H2 + S2(g) KC = 9,30.10-8 ở 427oC.
(a) Viết biểu thức hằng số cân bằng KC của phản ứng.
(b) Xác định biến thiên enthanpy chuẩn của phản ứng, biết nhệt tạo thành chuẩn của H2S(g) và S2(g) lần lượt là -20,6 kJ/mol và 128,6kJ/mol. Cho biết phản ứng thuận là tỏa nhiệt hay thu nhiệt.
(c) Ở 427oC, tính hằng số cân bằng K’C của phản ứng 2H2S (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2H2 + S2(g).
Câu 8: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:

(a) Tính \({\Delta _r}H_{298}^o\)của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 91,3 kJ/mol và -241,8 kJ/mol.
(b) Tính năng lượng liên kết trong phân tử NO.
Biết năng lượng liên kết N – H, O = O, O – H lần lượt là 386kJ/mol, 494 kJ/mol và 459kJ/mol.
Câu 9: Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:

(a) Viết các phương trình hoá học xảy ra.
(b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia?
Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Câu 10: Sulfuric acid có thể được điều chế từ quặng pyrite theo sơ đồ:
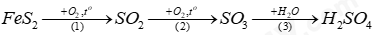
(a) Viết phương trình hóa học của các phản ứng xảy ra.
(b) Tính thể tích dung dịch H2SO4 95% (D = 1,82 g/mL) thu được từ 1 tấn quặng pyrite (chứa 80% FeS2). Biết hiệu suất của cả quá trình là 90%, các tạp chất trong quặng không chứa sulfur.
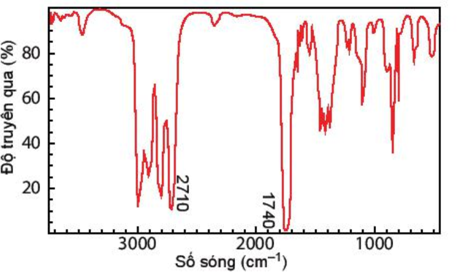
Câu 11: Hợp chất A có công thức phân tử C3H6O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Hãy xác định công thức cấu tạo của A.
Câu 12: Phân tích định lượng Atabrine, một loại thuốc chống sốt rét, người ta xác định được chất này chứa 69,1% carbon, 7,5% hydrogen, 10,5% nitrogen, 8,9% chlorine và 4,0% oxygen về khối lượng. Hãy xác định công thức thực nghiệm của Atabrine.
Câu 13: Người ta thực hiện chiết xuất tinh dầu hồi trong phòng thí nghiệm như sau:
– Giai đoạn 1 (xử lí nguyên liệu): Sau khi lấy về, quả hồi phải được xử lí sơ bộ nhằm loại bỏ các tạp chất cơ học chứa lẫn như lá, cành vụn, vỏ cây, đất cát… (không nên loại bỏ cuống của quả hồi vì cuống quả hồi có chứa một hàm lượng tinh dầu khá cao, từ 5,49% – 6,01%).
– Giai đoạn 2 (cán dập): Sau khi xử lí, nguyên liệu quả hồi dùng để chưng cát nên được cán dập.
– Giai đoạn 3: Chiết xuất tinh dầu hồi dựa trên cơ sở nhiệt độ sôi khác nhau giữa tinh dầu và nước có trong nguyên liệu.
– Giai đoạn 4: Tinh dầu hồi thu được ở giai đoạn 3 vẫn còn lẫn một ít nước, dù không đáng kể nhưng sẽ làm ảnh hưởng lớn đến chất lượng của tinh dầu hồi. Do đó, sau khi hoàn thành giai đoạn 3, tinh dầu hồi phải được khử nước bằng cách để lắng yên một ngày đêm trong phễu, sau đó tiến hành tách bỏ lớp nước phía dưới. Để dễ dàng hơn cho quá trình phân lớp, có thể cho thêm một ít muối ăn để làm tăng tỉ trọng của nước còn lẫn trong tinh dầu. Sau khi tách bỏ lớp nước phía dưới, lớp tinh dầu còn lại phía trên phễu vẫn còn chứa lẫn một lượng nước rất ít và sẽ được khử bỏ bằng cách xử lí với Na2SO4 khan.
Hãy cho biết phương pháp tách và tinh chế nào được sử dụng ở giai đoạn 3 và giai đoạn 4 trong quy trình trên.
Câu 14: Viết công thức cấu tạo các đồng phân mạch hở có cùng công thức phân tử C3H8O.
Lời giải:
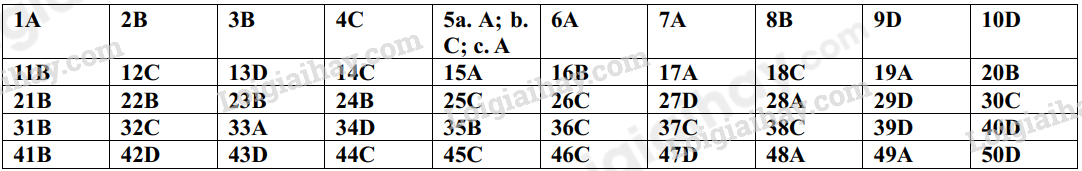
Phần trắc nghiệm
Phần tự luận
Câu 1: Phản ứng: \({\rm{COC}}{{\rm{l}}_{\rm{2}}}(g) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{CO}}(g) + {\rm{C}}{{\rm{l}}_{\rm{2}}}(g){\rm{ }}\) đạt trạng thái cân bằng ở 900 K.
Hằng số cân bằng của phản ứng có giá trị là 8,2×10-2. Giả sử nồng độ mol ở trạng thái cân bằng của CO và Cl2 là 0,150M. Tính nồng độ mol ở trạng thái cân bằng của COCl2.
Lời giải:
\({K_{\rm{C}}} = \frac{{{\rm{0,150 x 0,150}}}}{{{\rm{[COC}}{{\rm{l}}_{\rm{2}}}{\rm{]}}}} = 8,2{\rm{ x 1}}{{\rm{0}}^{ – 2}}\)\( \Rightarrow \)pH = 2.
Câu 2: Cho cân bằng hoá học sau: \(CO\left( g \right) + {H_2}O\left( g \right) \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {H_2}\left( g \right) + C{O_2}\left( g \right)\)
Ở 700 °C, hằng số cân bằng KC = 8,3. Cho 1 mol khí CO và 1 mol hơi nước vào bình kín dung tích 10 lít và giữ ở 700 °C. Tính nồng độ các chất ở trạng thái cân bằng.
Lời giải:

Câu 3: Cho các chất: HCl, Na2SO4, HF, CH3COOH, C2H5OH, CH4, Ba(OH)2, HClO.
(a) Phân loại các chất trên thành chất điện li mạnh, chất điện li yếu và chất không điện li.
(b) Viết phương trình điện li của các chất điện li.
Lời giải:
(a) Chất điện li mạnh: HCl, Na2SO4, Ba(OH)2.
Chất điện li yếu: HF, CH3COOH, HClO.
Chất không điện li: C2H5OH, CH4.
(b) Phương trình điện li:

Câu 4: Một học sinh làm thí nghiệm xác định độ pH của đất như sau: Lấy một lượng
đất cho vào nước rồi lọc lấy phần dung dịch. Dùng máy đo được giá trị pH là 4,52.
(a) Hãy cho biết môi trường của dung dịch là acid, base hay trung tính.
(b) Loại đất trên được gọi là đất chua. Hãy đề xuất biện pháp giảm độ chua, tăng độ pH của đất.
Lời giải:
(a) Vì có pH = 4,52 < 7 nên môi trường của dung dịch là acid.
(b) Loại đất có môi trường acid được gọi là đất chua. Biện pháp giảm độ chua là dùng calcium oxide (CaO) vì khi bón cho đất: \({\rm{CaO + }}{{\rm{H}}_{\rm{2}}}{\rm{O}}\,\, \to {\rm{Ca(OH}}{{\rm{)}}_2}\)tạo môi trường base trung hòa môi trường acid làm tăng độ pH của đất.
Câu 5: Một học sinh thực hiện thí nghiệm sau: Lấy 10ml dung dịch HCl 0,2M cho vào 5ml dung dịch NH3 thu được dung dịch A. Chuẩn độ lượng HCl dư trong dung dịch A bằng dung dịch NaOH 0,1M thấy phản ứng hết 10,2ml. Tính nồng độ NH3 ban đầu.
Lời giải:
Gọi n NH3 = x mol
HCl + NH3 –> NH4Cl
x
n HCl dư = 10.0,2.10-3 – x = 0,002 – x
n NaOH = 0,1 . 10,2 . 10-3 = 0,00102 mol = n HCl dư => 0,002 – x = 0,00102 => x = 0,001 mol
[NH3] = \(\frac{{0,001}}{{{{5.10}^{ – 3}}}} = 0,2M\)
Câu 6: Cho hỗn hợp gồm N2, H2, NH3 đi qua dung dịch H2SO4 đặc, dư thì thể tích khí còn lại một nửa. Thành phần % theo thể tích của NH3 trong hỗn hợp đầu là bao nhiêu?
Lời giải:
N2, H2, NH3 đi qua dung dịch H2SO4 đặc thì NH3 bị giữ lại => khí còn lại là N2 và H2
Giả sử ban đầu có 1 lít hỗn hợp => V NH3 = 0,5 lít; V N2 + H2 = 0,5 lít
%NH3 = 0,5 : 1 = 50%
Câu 7: Hydrogen sulfide phân hủy theo phản ứng sau đây:
2H2S (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2H2 + S2(g) KC = 9,30.10-8 ở 427oC.
(a) Viết biểu thức hằng số cân bằng KC của phản ứng.
(b) Xác định biến thiên enthanpy chuẩn của phản ứng, biết nhệt tạo thành chuẩn của H2S(g) và S2(g) lần lượt là -20,6 kJ/mol và 128,6kJ/mol. Cho biết phản ứng thuận là tỏa nhiệt hay thu nhiệt.
(c) Ở 427oC, tính hằng số cân bằng K’C của phản ứng 2H2S (g) \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \)2H2 + S2(g).
Lời giải:
a) \({K_C} = \frac{{{\rm{[}}{S_2}]{{{\rm{[}}{H_2}]}^2}}}{{{{{\rm{[}}{H_2}S]}^2}}}\)
b) \({\Delta _r}H_{298}^o = {\Delta _f}H_{298}^0({S_2}) – {\Delta _f}H_{298}^0({H_2}S) = 128,6 – ( – 20,6.2) = 169,8kJ\)
Vì có \({\Delta _r}H_{298}^0 > 0\)nên phản ứng thuận là phản ứng thu nhiệt
c) \({K_{C’}} = \frac{1}{{{K_C}}} = \frac{1}{{9,{{30.10}^{ – 8}}}} = 1,{08.10^7}\)
Câu 8: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:
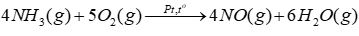
(a) Tính của phản ứng trên và cho biết phản ứng là toả nhiệt hay thu nhiệt? Có thể tận dụng nhiệt này để làm gì?
Biết nhiệt tạo thành chuẩn của NH3(g), NO(g) và H2O(g) lần lượt là -45,9 kJ/mol; 91,3 kJ/mol và -241,8 kJ/mol.
(b) Tính năng lượng liên kết trong phân tử NO.
Biết năng lượng liên kết N – H, O = O, O – H lần lượt là 386kJ/mol, 494 kJ/mol và 459kJ/mol.
Lời giải:
a) \(\begin{array}{l}{\Delta _r}H_{298}^0 = 4.{\Delta _f}H_{298}^0(NO) + 6.{\Delta _f}H_{298}^0({H_2}O) – 4.{\Delta _f}H_{298}^0(N{H_3})\\ = 4.91,3 + 6. – 241,8 – 4.( – 45,9) = – 902kJ\end{array}\)
Phản ứng này tỏa nhiệt vì \({\Delta _r}H_{298}^o\)< 0
Có thể sử dụng nhiệt này để cung cấp nhiệt cho các phản ứng hạt nhân, phản ứng thu nhiệt
b) \({\Delta _r}H_{298}^o\)= 4.3Eb(N-H) + 5Eb(O=O) – 6.2Eb(O-H) – 4.Eb(NO)
\( \Rightarrow \) 4.3.386 + 5.494 – 6.2.459 – 4Eb(NO) = -906 kJ \( \Rightarrow \) Eb(NO) = 625 kJ/mol
Câu 9: Trong công nghiệp, người ta sản xuất nitric acid (HNO3) từ ammonia theo sơ đồ chuyển hoá sau:
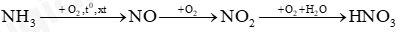
(a) Viết các phương trình hoá học xảy ra.
(b) Để điều chế 200 000 tấn nitric acid có nồng độ 60% cần dùng bao nhiêu tấn ammonia?
Biết rằng hiệu suất của quá trình sản xuất nitric acid theo sơ đồ trên là 96,2%.
Lời giải:

Câu 10: Sulfuric acid có thể được điều chế từ quặng pyrite theo sơ đồ:

(a) Viết phương trình hóa học của các phản ứng xảy ra.
(b) Tính thể tích dung dịch H2SO4 95% (D = 1,82 g/mL) thu được từ 1 tấn quặng pyrite (chứa 80% FeS2). Biết hiệu suất của cả quá trình là 90%, các tạp chất trong quặng không chứa sulfur.
Lời giải:

Câu 11: Hợp chất A có công thức phân tử C3H6O. Khi đo phổ hồng ngoại cho kết quả như hình dưới. Hãy xác định công thức cấu tạo của A.
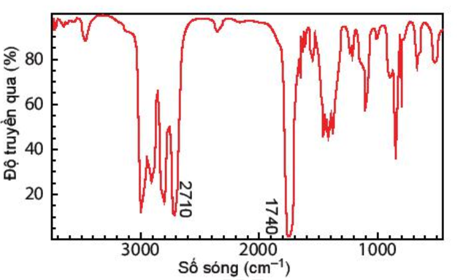
Lời giải:
Dựa vào tín hiệu đặc trưng trong phổ hồng ngoại IR ta thấy,
Có 2 vùng tín hiệu đặc trưng là 2710 cm-1 và 1740 cm-1 đây là 2 vùng tín hiệu đặc trưng của nhóm -CHO
Vậy trong hợp chất A có chứa nhóm chức – CHO
CTCT: CH3 – CH2 – CHO
Câu 12: Phân tích định lượng Atabrine, một loại thuốc chống sốt rét, người ta xác định được chất này chứa 69,1% carbon, 7,5% hydrogen, 10,5% nitrogen, 8,9% chlorine và 4,0% oxygen về khối lượng. Hãy xác định công thức thực nghiệm của Atabrine.
Lời giải:
\(\begin{array}{l}C:H:N:O:Cl = \frac{{\% {m_C}}}{{12}}:\frac{{\% {m_H}}}{1}:\frac{{\% {m_N}}}{{14}}:\frac{{\% {m_O}}}{{16}}:\frac{{\% {m_{Cl}}}}{{35,5}}\\ = \frac{{69,1}}{{12}}:\frac{{7,5}}{1}:\frac{{10,5}}{{14}}:\frac{4}{{16}}:\frac{{8,9}}{{35,5}} = 5,7:7,5:0,75:0,25:0,25\\ \approx 23:30:3:1:1\end{array}\)
CTPT: C23H30N3OCl
Câu 13: Người ta thực hiện chiết xuất tinh dầu hồi trong phòng thí nghiệm như sau:
– Giai đoạn 1 (xử lí nguyên liệu): Sau khi lấy về, quả hồi phải được xử lí sơ bộ nhằm loại bỏ các tạp chất cơ học chứa lẫn như lá, cành vụn, vỏ cây, đất cát… (không nên loại bỏ cuống của quả hồi vì cuống quả hồi có chứa một hàm lượng tinh dầu khá cao, từ 5,49% – 6,01%).
– Giai đoạn 2 (cán dập): Sau khi xử lí, nguyên liệu quả hồi dùng để chưng cát nên được cán dập.
– Giai đoạn 3: Chiết xuất tinh dầu hồi dựa trên cơ sở nhiệt độ sôi khác nhau giữa tinh dầu và nước có trong nguyên liệu.
– Giai đoạn 4: Tinh dầu hồi thu được ở giai đoạn 3 vẫn còn lẫn một ít nước, dù không đáng kể nhưng sẽ làm ảnh hưởng lớn đến chất lượng của tinh dầu hồi. Do đó, sau khi hoàn thành giai đoạn 3, tinh dầu hồi phải được khử nước bằng cách để lắng yên một ngày đêm trong phễu, sau đó tiến hành tách bỏ lớp nước phía dưới. Để dễ dàng hơn cho quá trình phân lớp, có thể cho thêm một ít muối ăn để làm tăng tỉ trọng của nước còn lẫn trong tinh dầu. Sau khi tách bỏ lớp nước phía dưới, lớp tinh dầu còn lại phía trên phễu vẫn còn chứa lẫn một lượng nước rất ít và sẽ được khử bỏ bằng cách xử lí với Na2SO4 khan.
Hãy cho biết phương pháp tách và tinh chế nào được sử dụng ở giai đoạn 3 và giai đoạn 4 trong quy trình trên.
Lời giải:
Giai đoạn 3 để chiết xuất tinh dầu người ta có thể sử dụng phương pháp chưng cất
Giai đoạn 4 sử dụng phương pháp kết tinh
Câu 14: Viết công thức cấu tạo các đồng phân mạch hở có cùng công thức phân tử C3H8O.
Lời giải:
C3H8O có k = 1
