Lời giải Đề thi giữa kì 1 Hóa 11 Chân trời sáng tạo – Đề số 1 – Đề thi giữa kì 1 – Đề số 1 – Đề thi đề kiểm tra Hóa lớp 11 Chân trời sáng tạo. Cho các phát biểu sau: (1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau….
Đề thi
Câu 1: Cho các phát biểu sau:
(1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
(2) Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
(3) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
(5) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là:
A. 2,3. B. 3,4. C. 3,5. D. 4,5.
Câu 2: Hằng số cân bằng K của phản ứng phụ thuộc vào
A. áp suất.
B. bản chất của các chất trong cân bằng và nhiệt độ.
C. nồng độ.
D. phân tử khối
Câu 3: Cho cân bằng sau: 2SO2(k) + O2(k) ⇄ 2SO3(k); ∆H = -192,5kJ
Để tăng hiệu suất của quá trình sản xuất SO3, người ta cần
A. giảm nhiệt độ của hệ phản ứng, dùng xúc tác.
B. giữ phản ứng ở nhiệt độ thường, giảm áp suất.
C. tăng nhiệt độ của hệ phản ứng, dùng xúc tác.
D. giảm nhiệt độ và tăng áp suất của hệ phản ứng.
Câu 4: Dãy chất nào dưới đây chỉ gồm những chất điện li mạnh?
A. HNO3, Cu(NO3)2, H3PO4, Ca(NO3)2. B. CaCl2, CuSO4, H2S, HNO3.
C. H2SO4, NaCl, KNO3, Ba(NO3)2. D. KCl, H2SO4, HNO2, MgCl2.
Câu 5: Theo thuyết Bronsted – Lowry chất nào sau đây là base?
A. Al3+ B. Cl– C. H3PO4. D. CO32-
Câu 6: Giá trị pH của dung dịch HCl 0,001M là
A. 3. B. 11. C. 12. D. 2.
Câu 7: Nạp đầy khi amoniac vào bình thuỷ tinh trong suốt, đậy bình NH3 bằng nút cao su có ống thuỷ tinh vuốt nhọn xuyên qua. Nhúng đầu ống thuỷ tinh vào một chậu thuỷ tinh chứa nước có pha thêm dung dịch phenolphthalein. Một lát sau, nước trong chậu phun vào bình thành những tia có màu hồng. Thí nghiệm này chứng tỏ được
A. NH3 tan nhiều trong nước.
B. NH3 là chất khí.
C. NH3 có tính bazơ và tan nhiều trong nước.
D. NH3 có mùi khai.
Câu 8: Trong phản ứng giữa khí ammonia và khí hydrogen chloride thành ammonium chloride ở dạng khí trắng, ammonia đóng vai trò là:
A. Acid. B. Base. C. Chất oxi hóa. D. Chất khử.
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị nào sau đây?
A. 14N. B. 13N. C. 15N. D. 12N.
Câu 10: Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar. B. 0,01 bar. C. 0,78 bar. D. 0,28 bar.
Câu 11: Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:

Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3. B. 1. C. 4. D. 2.
Câu 12: Quá trình đốt cháy hỗn hợp hơi nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh ra khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là:
A. Ammonia. B. Nitrogen dioxide. C. Nitrogen monoxide. D. Nitrogen.
Câu 13: Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O – H phân cực về oxygen.
(b) Nguyên tử N có số oxi hóa là +5.
(c) Nguyên tử N có hóa trị bằng 4.
(d) Liên kết cho – nhận N → O kém bền.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 14: Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 15: Cho sơ đồ phản ứng : C + HNO3 (đ) \( \to \) CO2 + NO2 + H2O. Tổng hệ số cân bằng của phản ứng là :
A. 12 B. 10 C. 11 D. 13
II. Tự luận
Câu 1 (2 điểm): Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450 °C có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Tính hiệu suất của phản ứng tổng hợp NH3.
Câu 2: (2 điểm) Xét cân bằng của dung dịch NH3 0,1 M ở 25 °C:
.\({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ – }{\rm{ }}{{\rm{K}}_{\rm{C}}}{\rm{ = 1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\).
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
—Hết—
Đáp án
I. TRẮC NGHIỆM
|
1C |
2B |
3D |
4C |
5B |
6A |
7C |
8B |
|
9A |
10C |
11A |
12C |
13C |
14B |
15A |
|
Câu 1: Cho các phát biểu sau:
(1) Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau.
(2) Phản ứng bất thuận nghịch là phản ứng xảy ra theo 1 chiều xác định
(3) Cân bằng hóa học là trạng thái mà phản ứng đã xảy ra hoàn toàn.
(4) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, lượng các chất sẽ không đổi.
(5) Khi phản ứng thuận nghịch đạt trạng thái cân bằng hóa học, phản ứng dừng lại.
Các phát biểu sai là:
A. 2,3. B. 3,4. C. 3,5. D. 4,5.
Hướng dẫn:
Dựa vào lí thuyết về cân bằng hóa học
Lời giải:
(1) đúng
(2) đúng
(3) sai
(4) đúng
(5) sai
Đáp án C
Câu 2: Hằng số cân bằng K của phản ứng phụ thuộc vào
A. áp suất.
B. bản chất của các chất trong cân bằng và nhiệt độ.
C. nồng độ.
D. phân tử khối
Hướng dẫn:
Dựa vào các yếu tố ảnh hưởng đến hằng số cân bằng.
Lời giải:
Hằng số cân bằng K của phản ứng chỉ phụ thuộc vào bản chất của các chất trong cân bằng và nhiệt độ.
Đáp án B.
Câu 3: Cho cân bằng sau: 2SO2(k) + O2(k) ⇄ 2SO3(k); ∆H = -192,5kJ
Để tăng hiệu suất của quá trình sản xuất SO3, người ta cần
A. giảm nhiệt độ của hệ phản ứng, dùng xúc tác.
B. giữ phản ứng ở nhiệt độ thường, giảm áp suất.
C. tăng nhiệt độ của hệ phản ứng, dùng xúc tác.
D. giảm nhiệt độ và tăng áp suất của hệ phản ứng.
Hướng dẫn:
Dựa vào nguyên lí chuyển dịch Le – cha – tơ – lie
Lời giải:
Để tăng hiệu suất quá trình sản xuất SO3, tức là cân bằng chuyển dịch theo chiều thuận
Phản ứng có ∆H = -192,5Kj < 0, phản ứng tỏa nhiệt cần gảm nhiệt độ để cân bằng chuyển dịch theo chiều thuận
Phản ứng có sự chênh lệch mol khí, tổng mol khí tham gia nhiều hơn sản phẩm nên tăng áp suất để cân bằng chuyển dịch theo chiều thuận
Đáp án D
Câu 4: Dãy chất nào dưới đây chỉ gồm những chất điện li mạnh?
A. HNO3, Cu(NO3)2, H3PO4, Ca(NO3)2. B. CaCl2, CuSO4, H2S, HNO3.
C. H2SO4, NaCl, KNO3, Ba(NO3)2. D. KCl, H2SO4, HNO2, MgCl2.
Hướng dẫn:
Chất điện li mạnh: acid mạnh, dung dịch base, dung dịch muối tan
Lời giải:
Đáp án C
Câu 5: Theo thuyết Bronsted – Lowry chất nào sau đây là base?
A. Al3+ B. Cl– C. H3PO4. D. CO32-
Hướng dẫn:
Theo thuyết Bronsted – Lowry base là chất nhận proton H+
Lời giải:
Đáp án B
Câu 6: Giá trị pH của dung dịch HCl 0,001M là
A. 3. B. 11. C. 12. D. 2.
Hướng dẫn:
pH = -lg [H+]
Lời giải:
pH = -lg(0,001) = 3
Đáp án A
Câu 7: Nạp đầy khí amoniac vào bình thuỷ tinh trong suốt, đậy bình NH3 bằng nút cao su có ống thuỷ tinh vuốt nhọn xuyên qua. Nhúng đầu ống thuỷ tinh vào một chậu thuỷ tinh chứa nước có pha thêm dung dịch phenolphthalein. Một lát sau, nước trong chậu phun vào bình thành những tia có màu hồng. Thí nghiệm này chứng tỏ được
A. NH3 tan nhiều trong nước.
B. NH3 là chất khí.
C. NH3 có tính bazơ và tan nhiều trong nước.
D. NH3 có mùi khai.
Hướng dẫn:
Chất làm đổi màu phenolphthalein có tính base
Lời giải:
Đáp án C
Câu 8: Trong phản ứng giữa khí ammonia và khí hydrogen chloride thành ammonium chloride ở dạng khí trắng, ammonia đóng vai trò là:
A. Acid. B. Base. C. Chất oxi hóa. D. Chất khử.
Hướng dẫn:
Phản ứng giữa khí NH3 và HCl là phản ứng acid – base, trong đó NH3 đóng vai trò base
Lời giải:
Đáp án B
Câu 9: Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị nào sau đây?
A. 14N. B. 13N. C. 15N. D. 12N.
Hướng dẫn:
Nitrogen trong tự nhiên là hỗn hợp của hai đồng vị: (99,63%) và (0,37%).
Lời giải:
Trong tự nhiên, nguyên tố nitrogen tồn tại chủ yếu ở dạng đồng vị 14N.
Đáp án A.
Câu 10: Áp suất riêng phần của khí nitrogen trong khí quyển là
A. 0,21 bar. B. 0,01 bar. C. 0,78 bar. D. 0,28 bar.
Hướng dẫn:
Áp suất riêng phần là áp suất của một loại khí trong hỗn hợp khí tác động lên môi trường xung quanh. Trong một hỗn hợp các chất khí, mỗi khí có một áp suất riêng phần hay áp suất từng phần là áp suất của khí đó nếu giả thiết rằng một mình nó chiếm toàn bộ thể tích của hỗn hợp ban đầu ở cùng một nhiệt độ. Áp suất tổng của một hỗn hợp khí lý tưởng là tổng của các áp suất riêng phần của những khí trong hỗn hợp.
Lời giải:
Trong tự nhiên, áp suất của khí quyển là 1 bar. Khí nitrogen chiếm khoảng 78% thể tích không khí, cũng tương đương với 78% về áp suất.
Áp suất riêng phần của khí nitrogen trong khí quyển là 78% . 1 = 0.78 bar
→ Chọn C.
Câu 11: Cho sơ đồ chuyển hoá nitrogen trong khí quyển thành phân đạm:
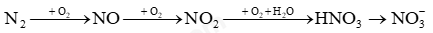
Số phản ứng thuộc loại oxi hoá-khử trong sơ đồ là
A. 3. B. 1. C. 4. D. 2.
Hướng dẫn:
Phản ứng oxi hóa khử là phản ứng hóa học, trong đó có sự chuyển electron giữa các chất trong phản ứng hay phản ứng oxi hóa khử là phản ứng hóa học trong đó có sự thay đổi số oxi hóa của một số nguyên tố.
Lời giải:

Các phản ứng (1), (2), (3) có sự thay đổi số oxi hóa của một số nguyên tố. Do đó các phản ứng này là phản ứng oxi hóa khử.
→ Chọn A.
Câu 12: Quá trình đốt cháy hỗn hợp hơi nhiên liệu và không khí trong động cơ khi đánh tia lửa điện sinh ra khí NO, một tác nhân gây ô nhiễm không khí. Tên gọi của NO là:
A. Ammonia. B. Nitrogen dioxide. C. Nitrogen monoxide. D. Nitrogen.
Lời giải:
Đáp án C
Câu 13: Cho các nhận định sau về cấu tạo phân tử nitric acid:
(a) Liên kết O – H phân cực về oxygen.
(b) Nguyên tử N có số oxi hóa là +5.
(c) Nguyên tử N có hóa trị bằng 4.
(d) Liên kết cho – nhận N → O kém bền.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn:
Dựa vào cấu tạo của nitric acid
Lời giải:
(a) đúng vì O có độ âm điện lớn hơn
(b) đúng vì N thể hiện hóa trị 5
(c) sai
(d) đúng
Đáp án C
Câu 14: Cho các nhận định sau về tính chất hóa học của nitric acid: (1) có tính acid mạnh; (2) có tính acid yếu; (3) có tính oxi hóa mạnh; (4) có tính khử mạnh.
Số nhận định đúng là
A. 1. B. 2. C. 3. D. 4.
Hướng dẫn:
Dựa vào tính chất hóa học của HNO3
Lời giải:
(1), (3) đúng
Câu 15: Cho sơ đồ phản ứng : C + HNO3 (đ) \( \to \) CO2 + NO2 + H2O. Tổng hệ số cân bằng của phản ứng là :
A. 12 B. 10 C. 11 D. 13
Hướng dẫn:
Cân bằng phương trình theo phương pháp thăng bằng electron
Lời giải:
\(\begin{array}{l}{C^o} \to {C^{ + 4}} + 4e|x1\\{N^{ + 5}} + 1e \to {N^{ + 4}}|x4\\C + 4HN{O_3} \to C{O_2} + 4N{O_2} + 2{H_2}O\end{array}\)
Đáp án A
II. TỰ LUẬN (4 điểm)
Câu 1 (2 điểm): Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4. Nung nóng X trong bình kín ở nhiệt độ khoảng 450 °C có bột Fe xúc tác, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 4. Tính hiệu suất của phản ứng tổng hợp NH3 ?
Hướng dẫn:
Sử dụng công thức: \({\rm{H\% }} = \frac{{{{\rm{n}}_{{\rm{sp(tt)}}}}}}{{{{\rm{n}}_{{\rm{sp(lt)}}}}}} \times 100\% \)
Lời giải:
Hỗn hợp X gồm N2 và H2 có tỉ lệ mol tương ứng là 1 : 4.
Chọn \({{\rm{n}}_{{{\rm{N}}_{\rm{2}}}}} = 1{\rm{ (mol)}};{\rm{ }}{{\rm{n}}_{{{\rm{H}}_{\rm{2}}}}} = 4{\rm{ }}({\rm{mol}})\)
Gọi x (mol) là số mol N2 phản ứng.
Xét cân bằng:

Câu 2: (2 điểm) Xét cân bằng của dung dịch NH3 0,1 M ở 25 °C:
\({\rm{N}}{{\rm{H}}_{\rm{3}}} + {{\rm{H}}_{\rm{2}}}{\rm{O}} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{NH}}_4^ + + {\rm{O}}{{\rm{H}}^ – }{\rm{ }}{{\rm{K}}_{\rm{C}}}{\rm{ = 1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\)
Bỏ qua sự phân li của nước. Xác định giá trị pH của dung dịch trên.
Hướng dẫn:
Tổng quát, nếu có phản ứng thuận nghịch sau: aA+bB \( \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} \) cC +dD
Khi phản ứng ở trạng thái cân bằng, ta có: \({{\rm{K}}_{\rm{C}}}{\rm{ = }}\frac{{{{{\rm{[C]}}}^{\rm{c}}}{{{\rm{[D]}}}^{\rm{d}}}}}{{{{{\rm{[A]}}}^{\rm{a}}}{{{\rm{[B]}}}^{\rm{b}}}}}\)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hoá học.
Tính nồng độ ion \({\rm{O}}{{\rm{H}}^ – }\)rồi sử dụng công thức pH = 14 – pOH.
Lời giải:
Xét cân bằng: \({\rm{N}}{{\rm{H}}_{\rm{3}}}{\rm{ }} + {\rm{ }}{{\rm{H}}_{\rm{2}}}{\rm{O }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ NH}}_4^ + {\rm{ }} + {\rm{ O}}{{\rm{H}}^ – }{\rm{ }}\)
Ban đầu (M): 0,1 0 0
Phản ứng (M): x ← x ← x
Cân bằng (M): 0,1 – x x x
Ta có: KC = \({\rm{1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\)
\(\begin{array}{l}\frac{{[{\rm{NH}}_4^ + ][{\rm{O}}{{\rm{H}}^ – }]}}{{[{\rm{N}}{{\rm{H}}_{\rm{3}}}]}} = {\rm{1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\\ \Leftrightarrow \frac{{{{\rm{x}}^2}}}{{0,1 – {\rm{x}}}} = {\rm{1,74}}{\rm{.1}}{{\rm{0}}^{ – 5}}\\ \Rightarrow {\rm{x}} \approx 1,{31.10^{ – 3}}{\rm{ (M)}} \Rightarrow {\rm{[O}}{{\rm{H}}^ – }{\rm{] = }}1,{31.10^{ – 3}}{\rm{ (M)}}\\ \Rightarrow {\rm{pOH = – log}}1,{31.10^{ – 3}} \approx 2,88\\ \Rightarrow {\rm{pH = 14 – pOH = }}14 – 2,88 = 11,12\end{array}\)