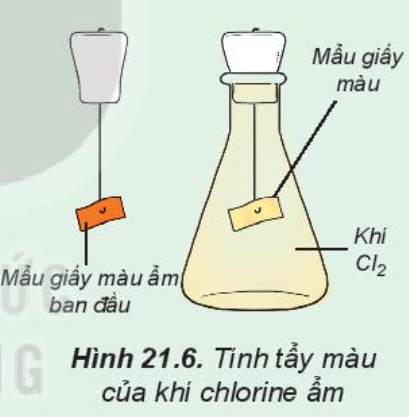
Đáp án Câu hỏi trang 109 Hoạt động Bài 21. Nhóm halogen SGK Hóa 10 Kết nối tri thức. Tham khảo: Mẩu giấy màu bị nhạt dần.
Câu hỏi/Đề bài:
|
Tìm hiểu tính tẩy màu của khí chlorine ẩm Tiến hành: Đính một mẩu giấy màu ẩm vào thanh kim loại gắn với nút đậy bình tam giác. Sau đó, đưa mầu giấy vào bình tam giác chứa khí chlorine (Hình 21.6). Quan sát hiện tượng và trả lời câu hỏi: 1. Nhận xét màu của mẩu giấy trước và sau khi cho vào bình tam giác. Giải thích 2. Xác định vai trò của chlorine trong phản ứng với nước, tại sao nói chlorine tự oxi hóa – tự khử trong phản ứng này? |
Hướng dẫn:
1. Mẩu giấy màu bị nhạt dần
2. Cl2 vừa là chất oxi hóa vừa là chất khử
Lời giải:
1.
– Trước khi cho vào bình khí chlorine, mẩu giấy màu vẫn giữ nguyên màu ban đầu
– Sau khi cho vào bình khí chlorine, mẩu giấy màu bị nhạt màu dần
– Giải thích:
+ Khi cho mẩu giấy ẩm vào bình chlorine, Cl2 đã tác dụng với H2O tạo thành HCl và HClO
$C{l_2} + {H_2}O \rightleftarrows HCl + HClO$
+ HClO có tính oxi hóa mạnh nên Cl2 trong H2O có khả năng tẩy màu, diệt khuẩn
2.
– Xét số oxi hóa của Cltrong phản ứng:
$Cl_2^0 + {H_2}O \rightleftarrows HC{l^{ – 1}} + H\mathop {Cl}\limits^{ + 1} O$
– Nhận xét: Trong phản ứng, Cl2 vừa là chất oxi hóa vừa là chất khử vì
+ Cl0 nhận thêm electron để thành Cl-1 => Chất oxi hóa
+ Cl0 nhường đi electron để thành Cl+1 => Chất khử
=> Trong phản ứng này, chlorine tự oxi hóa – tự khử