Trả lời Câu hỏi trang 94 Mở đầu Bài 15. Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng SGK Hóa 10 Chân trời sáng tạo.
Câu hỏi/Đề bài:
|
Trong tự nhiên có những phản ứng xảy ra rất nhanh, như phản ứng nổ của pháo hoa, phản ứng cháy của que diêm,… nhưng cũng có những phản ứng xảy ra chậm hơn, như quá trình oxi hóa các kim loại sắt, đồng trong khí quyển, sự ăn mòn vỏ tàu biển làm bằng thép,… Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học cần dùng đại lượng nào? Cách tính ra sao?
|
Lời giải:
– Để đánh giá mức độ nhanh hay chậm của một phản ứng hóa học, người ta dùng đại lượng: tốc độ phản ứng
– Cách tính: Cho phản ứng tổng quát:
aA + bB → cC + dD
Biểu thức tốc độ trung bình của phản ứng:
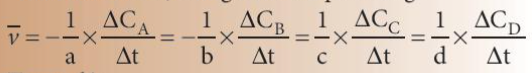
Trong đó:
\(\mathop v\limits^\_ \): tốc độ trung bình của phản ứng
∆C = C2 – C1: sự biến thiên nồng độ
∆t = t2 – t1: biến thiên thời gian
C1, C2 là nồng độ của một chất tại 2 thời điểm tương ứng t1, t2
