Lời giải Câu hỏi trang 89 Luyện tập Bài 14. Tính biến thiên enthalpy của phản ứng hóa học SGK Hóa 10 Chân trời sáng tạo. Tham khảo: Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng.
Câu hỏi/Đề bài:
|
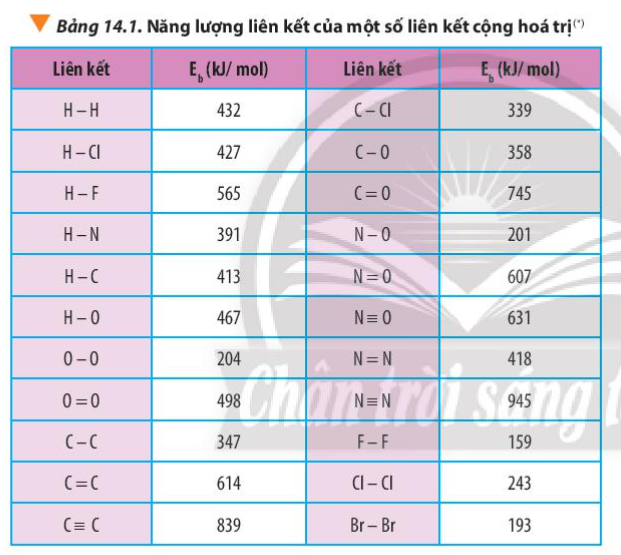
Xác định \({\Delta _r}H_{298}^o\) của phản ứng sau dựa vào giá trị Eb ở Bảng 14.1: CH4(g) + Cl2(g) \(\xrightarrow{{askt}}\) CH3Cl(g) + HCl(g) Hãy cho biết phản ứng trên tỏa nhiệt hay thu nhiệt? |
Hướng dẫn:
Bước 1: Xác định số lượng liên kết và loại liên kết của các chất trong phản ứng
Bước 2: Áp dụng công thức: \({\Delta _r}H_{298}^o\) = \(\Sigma \)Eb(cđ) – \(\Sigma \)Eb(sp)
=> Phản ứng thu nhiệt hay tỏa nhiệt
Lời giải:
CH4(g) + Cl2(g) \(\xrightarrow{{askt}}\) CH3Cl(g) + HCl(g)
– Chất đầu:
+ CH4 có 4 liên kết C-H
+ Cl2 có 1 liên kết Cl-Cl
– Sản phẩm
+ CH3Cl có 3 liên kết C-H, 1 liên kết C-Cl
+ HCl có 1 liên kết H-Cl
Mà: \({\Delta _r}H_{298}^o\) = \(\Sigma \)Eb(cđ) – \(\Sigma \)Eb(sp)
=> \({\Delta _r}H_{298}^o\) = Eb(CH4) + Eb(Cl2) – Eb(CH3Cl)- Eb(HCl)
= 4 Eb(C-H) + Eb(Cl-Cl) – 3Eb(C-H) – Eb(C-Cl) – Eb(H-Cl)
= 4.413 + 243 – 3. 413 – 339 – 427 = -110 kJ/mol < 0
=> Phản ứng tỏa nhiệt