Hướng dẫn giải Câu hỏi trang 75 Luyện tập Bài 12. Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống SGK Hóa 10 Chân trời sáng tạo. Gợi ý: Phản ứng oxi hóa – khử là phản ứng hóa học.
Câu hỏi/Đề bài:
|
Cho phương trình hóa học của các phản ứng sau: H2S + Br2 → 2HBr + S↓ (1) 2KClO3 2KCl + 3O2↑ (2) CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O (3) Phản ứng nào là phản ứng oxi hóa – khử? Vì sao? Hãy xác định quá trình oxi hóa và quá trình khử của các phản ứng đó |
Hướng dẫn:
– Phản ứng oxi hóa – khử là phản ứng hóa học, trong đó có sự chuyển dịch electron giữa các chất phản ứng hay có sự thay đổi số oxi hóa của một số nguyên tử trong phân tử
– Quá trình oxi hóa là quá trình nhường electron
– Quá trình khử là quá trình nhận electron
Lời giải:
– Xét phản ứng (1):
\({H_2}\mathop S\limits^{ – 2} + {\mathop {Br}\limits^0 _2} \to H\mathop {Br}\limits^{ – 1} + \mathop S\limits^0 \downarrow \)
+ Là phản ứng oxi hóa – khử vì nguyên tử S và Br có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: S-2 → S0 + 2e
+ Quá trình khử: Br20 + 2e → Br-1
– Xét phản ứng (2): 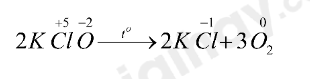
+ Là phản ứng oxi hóa – khử vì nguyên tử Cl và O có sự thay đổi số oxi hóa
+ Quá trình oxi hóa: 2O-2 → O20 + 4e
+ Quá trình khử: Cl+5 + 6e → Cl-1
– Xét phản ứng (3): CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
+ Không phải phản ứng oxi hóa – khử vì các nguyên tử không có sự thay đổi số oxi hóa