Trả lời Bài tập 5 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học (trang 88, 89, 90, 91, 92, 93) – SGK Hóa 10 Chân trời sáng tạo. Hướng dẫn: Áp dụng công thức: \({\Delta _r}H_{298}^o\)= \(\Sigma \)\({\Delta _f}H_{298}^o\)(sp) – \(\Sigma \)\({\Delta _f}H_{298}^o\.
Câu hỏi/Đề bài:
|
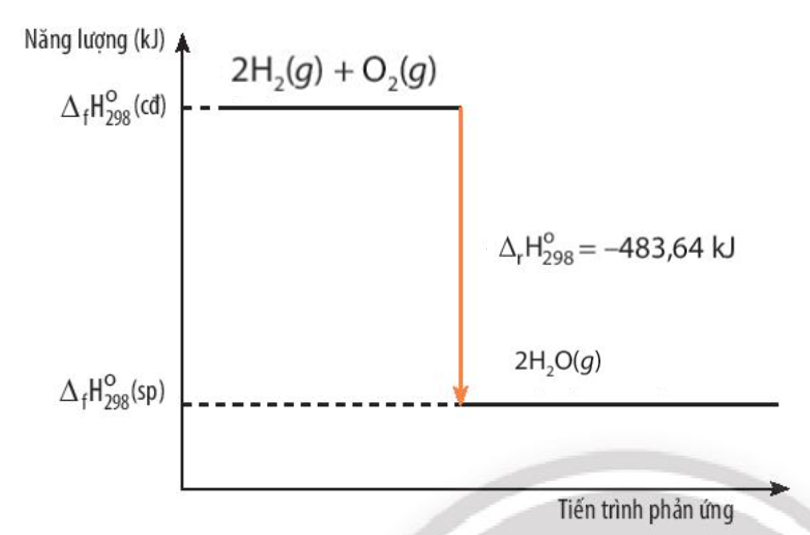
Bài 5: Khí hydrogen cháy trong không khí tạo thành nước theo phương trình hóa học sau: 2H2(g) + O2(g) → 2H2O(g) \({\Delta _r}H_{298}^o\) = -483,64 kJ a) Nước hay hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn? Giải thích b) Vẽ sơ đồ biến thiên năng lượng của phản ứng giữa hydrogen và oxygen |
Hướng dẫn:
Áp dụng công thức: \({\Delta _r}H_{298}^o\)= \(\Sigma \)\({\Delta _f}H_{298}^o\)(sp) – \(\Sigma \)\({\Delta _f}H_{298}^o\)(bđ)
Lời giải:
a) Xét phản ứng: 2H2(g) + O2(g) → 2H2O(g)
\({\Delta _r}H_{298}^o\)= \(\Sigma \)\({\Delta _f}H_{298}^o\)(sp) – \(\Sigma \)\({\Delta _f}H_{298}^o\)(bđ)
= 2.\({\Delta _f}H_{298}^o\)(H2O) – \({\Delta _f}H_{298}^o\)(O2) – 2. \({\Delta _f}H_{298}^o\)(H2) = -483,64 kJ < 0
=> Hỗn hợp của oxygen và hydrogen có năng lượng lớn hơn
b)