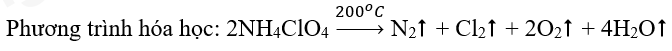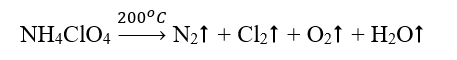Hướng dẫn giải Bài tập 5 Bài 12. Phản ứng oxi hóa – khử và ứng dụng trong cuộc sống (trang 72, 73, 74) – SGK Hóa 10 Chân trời sáng tạo. Hướng dẫn: Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản.
Câu hỏi/Đề bài:
|
Bài 5: Nhiên liệu rắn dành cho tên lửa tăng tốc của tàu vũ trụ con thoi là hỗn hợp gồm ammonium perchlorate (NH4ClO4) và bột nhôm. Khi được đốt đến trên 200oC, ammonium perchlorate nổ theo phản ứng sau:
Lập phương trình hóa học của phản ứng bằng phương pháp thăng bằng electron. |
Hướng dẫn:
Bước 1: Xác định số oxi hóa của các nguyên tử có sự thay đổi số oxi hóa trong phản ứng, từ đó xác định chất oxi hóa, chất khử
Bước 2: Viết quá trình oxi hóa và quá trình khử. Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron
Bước 3: Xác định (và nhân) hệ số thích hợp vào các quá trình sao cho tổng số electron chất khửu nhường = tổng số electron chất oxi hóa nhận
Bước 4: Đặt các hệ số vào sơ đồ phản ứng. Cân bằng số lượng nguyên tử của các nguyên tố còn lại
Lời giải:
Sơ đồ phản ứng: \(\mathop N\limits^{ – 3} {H_4}\mathop {Cl}\limits^{ + 7} {\mathop O\limits^{ – 2} _4}\xrightarrow{{{{200}^o}C}}{\mathop N\limits^0 _2} \uparrow + {\mathop {Cl}\limits^0 _2} \uparrow + {\mathop O\limits^0 _2} \uparrow + {H_2}O\)
Quá trình oxi hóa: $\mathop {2N}\limits^{ – 3} \to \mathop {{N_2}}\limits^0 + 2.3e$
$\mathop {4O}\limits^{ – 2} \to 2\mathop {{O_2}}\limits^0 + 4.2e$
Quá trình khử: $2\mathop {Cl}\limits^{ + 7} + 2.7e \to {\mathop {Cl}\limits^0 _2}$
|
1x |
$\mathop {2N}\limits^{ – 3} \to \mathop {{N_2}}\limits^0 + 2.3e$ $\mathop {4O}\limits^{ – 2} \to 2\mathop {{O_2}}\limits^0 + 4.2e$ ð Tổng: 14 e nhường |
|
1x |
$2\mathop {Cl}\limits^{ + 7} + 2.7e \to {\mathop {Cl}\limits^0 _2}$ |