Đáp án Vận dụng 6.23 Bài 6. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một chu kì và trong một nhóm (trang 15, 16, 17) – SBT Hóa 10 Kết nối tri thức. Tham khảo: Xu hướng biến đổi bán kính nguyên tử.
Câu hỏi/Đề bài:
Cho các nguyên tố X, Y, Z có số hiệu nguyên tử lần lượt là 11, 13, 19.
a) Xác định vị trí của các nguyên tố đó trong bảng tuần hoàn.
b) Xếp các nguyên tố đó theo thứ tự bán kính nguyên tử tăng dần.
c) Gán các giá trị độ âm điện (0,82 ; 1,31 và 0,93) cho X, Y, Z.
d) Xếp các nguyên tố đó theo thứ tự tính kim loại giảm dần.
Hướng dẫn:
– Xu hướng biến đổi bán kính nguyên tử:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng dần
– Xu hướng biến đổi độ âm điện:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, độ âm điện tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, độ âm điện giảm dần
– Xu hướng biến đổi tính kim loại, tính phi kim:
+ Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần, tính phi kim tăng dần
+ Trong một nhóm, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần
– Cách thực hiện:
+ Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn (chu kì nào? Nhóm nào?)
+ Bước 2: Dựa vào xu hướng biến đổi tính kim loại, tính phi kim để xác định đáp án đúng
Lời giải:
a) – Bước 1: Xác định vị trí các nguyên tố trong bảng tuần hoàn
+ Nguyên tố X có Z = 11 => Cấu hình electron của X là: 1s22s22p63s1
=> X thuộc chu kì 3, nhóm IA
+ Nguyên tố Y có Z = 13 => Cấu hình electron của Y là: 1s22s22p63s23p1
=> Y thuộc chu kì 3, nhóm IIIA
+ Nguyên tố Z có Z = 19 => Cấu hình electron của Z là: 1s22s22p63s23p64s1
=> Z thuộc chu kì 4, nhóm IA
b + c + d)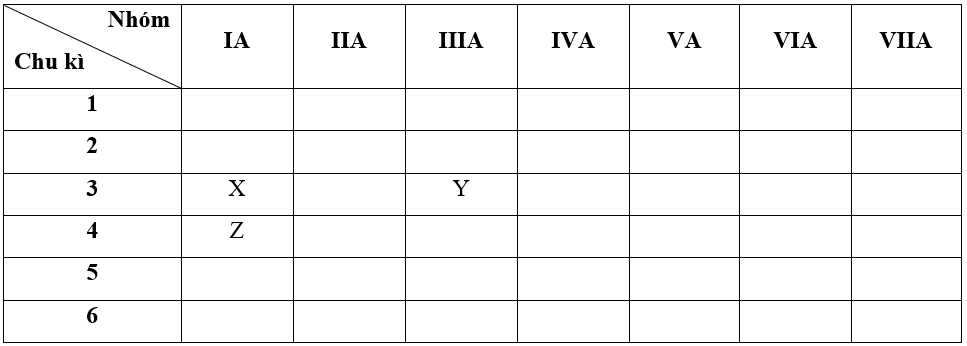 – Bước 2: Dựa vào các xu hướng biến đổi
– Bước 2: Dựa vào các xu hướng biến đổi
+ Xu hướng biến đổi bán kính nguyên tử
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần bán kính nguyên tử là: Y < X (1)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều tăng dần tính bán kính nguyên tử là: X < Z (2)
=> Từ (1) và (2) ta có dãy sắp xếp theo chiều tăng dần bán kính nguyên tử:
Y < X < Z
+ Xu hướng biến đổi độ âm điện
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: Y > X (3)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần độ âm điện là: X > Z (4)
=> Từ (3) và (4) ta có dãy sắp xếp theo chiều giảm dần độ âm điện:
Y > X > Z
=> Độ âm điện của các nguyên tố Y, X và Z lần lượt là: 1,31; 0,93 và 0,82
+ Xu hướng biến đổi tính kim loại, tính phi kim
Trong cùng một chu kì 3, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: X > Y (5)
Trong cùng một nhóm IA, theo chiều tăng dần về điện tích hạt nhân, ta có chiều giảm dần tính kim loại là: Z > X (6)
=> Từ (5) và (6) ta có dãy sắp xếp theo chiều giảm dần tính kim loại:
Z > X > Y