Giải chi tiết Câu 7.5 Bài 7. Định luật tuần hoàn – Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học (trang 24, 25) – SBT Hóa 10 Chân trời sáng tạo. Hướng dẫn: Khi có cấu hình electron lớp ngoài cùng của nguyên tử.
Câu hỏi/Đề bài:
Phosphorus được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Nguyên tố phosphorus ở ô số 15, chu kì 3, nhóm VA trong bảng tuần hoàn. Hãy cho biết:
– Cấu hình electron của phosphorus.
– Số electron lớp ngoài cùng của nguyên tử phosphorus
– Phosphorus là kim loại hay phi kim.
– Công thức oxide cao nhất của phosphorus.
– Công thức hợp chất khí của phosphorus với hydrogen.
– Công thức hydroxide cao nhất của phosphorus.
– Oxide và hydroxide cao nhất của phosphorus có tính acid hay base.
Hướng dẫn:
– Khi có cấu hình electron lớp ngoài cùng của nguyên tử
+ TH1: các lớp trước đó đã được lấp đầy electron
+ TH2: trước lớp ngoài cùng vẫn có lớp chưa được lấp đầy electron (do có phân lớp d hoặc phân lớp f). Áp dụng với nguyên tử có cấu hình electron lớp ngoài cùng từ 4s trở lên
– Từ cấu hình electron của nguyên tử
+ Số lớp electron = số chu kì
+ Số electron lớp ngoài cùng = số nhóm (đối với các nguyên tố nhóm A)
+ Ô số thứ tự = điện tích hạt nhân = số proton = số electron
– Công thức oxide cao nhất và hợp chất khí với hydrogen của các nguyên tố từ IA đến VIIA
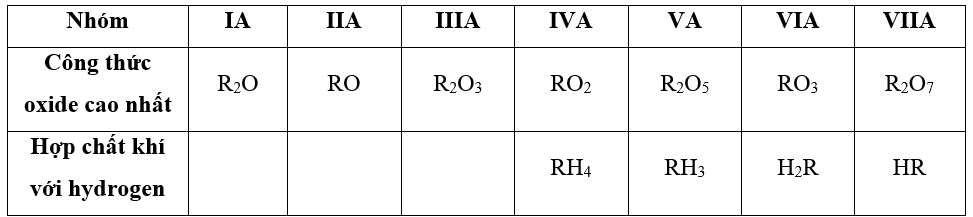
Lời giải:
– Nguyên tố phosphorus ở chu kì 3, nhóm VA
=> Cấu hình electron lớp ngoài cùng: 3s23p3
=> Cấu hình electron của nguyên tố này là 1s22s22p63s23p3
=> Số electron lớp ngoài cùng của nguyên tử phosphorus: 5
=> Vì có 5 electron lớp ngoài cùng nên phosphorus là phi kim
– Nguyên tố phosphorus ở nhóm VA
=> Công thức oxide cao nhất của phosphorus là P2O5
=> Công thức hợp chất khí với hydrogen: PH3
=> Công thức hydroxide cao nhất: H3PO4
– Do phosphorus có tính phi kim nên P2O5 và H3PO4 có tính acid