Giải Câu 16.16 Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học (trang 67, 68, 69) – SBT Hóa 10 Chân trời sáng tạo. Gợi ý: aA + bB -> cC + dD là \(\overline v = – \frac{1}{a}. \frac{{\Delta {C_A}}}{{\Delta t}} = – \frac{1}{b}.
Câu hỏi/Đề bài:
Aspirin (acetylsalicylic acid, C9H8O4) là thuốc hạ sốt, giảm đau, có tính kháng viêm, được sử dụng khá phổ biến trên thế giới, khoảng 25000 tấn mỗi năm. Khi uống aspirin, phản ứng thuỷ phân xảy ra như sau:
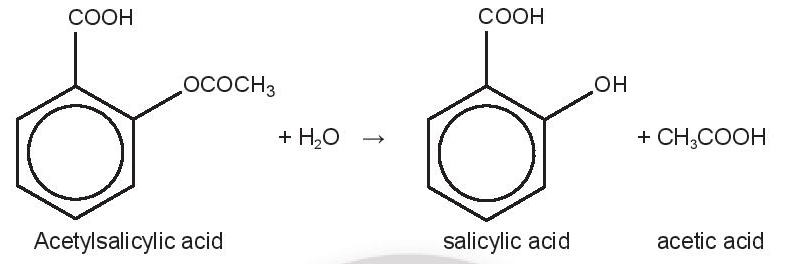
Salicylic acid là thành phần chính có tác dụng hạ sốt, giảm đau và viêm nhiễm, nên có nhiều nghiên cứu tập trung vào phản ứng thuỷ phân này và các yếu tố ảnh hưởng đến tốc độ phản ứng. Dữ liệu về quá trình thuỷ phân của một mẫu aspirin trong nước (môi trường trung tính) ở 37°C thể hiện trong bảng:
|
Thời gian (h) |
Nồng độ aspirin (M) |
Nồng độ salicylic acid (M) |
|
0 |
5,55.10-3 |
0 |
|
2 |
5,51.10-3 |
0,040.10-3 |
|
5 |
5,45.10-3 |
0,10.10-3 |
|
10 |
5,35.10-3 |
0,20.10-3 |
|
20 |
5,15.10-3 |
0,40.10-3 |
|
30 |
4,96.10-3 |
0,59.10-3 |
|
40 |
4,78.10-3 |
0,77.10-3 |
|
50 |
4,61.10-3 |
0,94.10-3 |
|
100 |
3,83.10-3 |
1,72.10-3 |
|
200 |
2,64.10-3 |
2,91.10-3 |
|
300 |
1,82.10-3 |
3,73.10-3 |
(*) Ở điều kiện này, phản ứng xảy ra rất chậm, trong môi trường acid, như điều kiện trong dạ dày, phản ứng xảy ra nhanh hơn.
a) Tính tốc độ trung bình của phản ứng thuỷ phân aspirin sau thời gian 2, 5, 10,…, 300 giờ.
b) Nhận xét sự thay đổi tốc độ phản ứng theo thời gian. Giải thích.
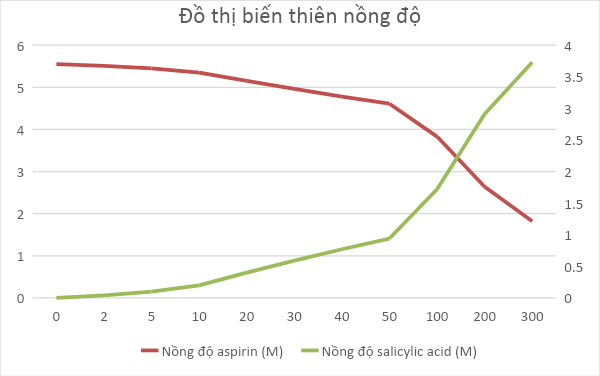
c) Vẽ đồ thị biểu diễn sự biến thiên nồng độ chất tham gia và sản phẩm theo thời gian của phản ứng trên.
Hướng dẫn:
aA + bB -> cC + dD là \(\overline v = – \frac{1}{a}.\frac{{\Delta {C_A}}}{{\Delta t}} = – \frac{1}{b}.\frac{{\Delta {C_B}}}{{\Delta t}} = \frac{1}{c}.\frac{{\Delta {C_C}}}{{\Delta t}} = \frac{1}{d}.\frac{{\Delta {C_D}}}{{\Delta t}}\)
+ \(\overline v \): tốc độ trung bình của phản ứng
+ \(\Delta C = {C_2} – {C_1}\): sự biến thiên nồng độ
+ \(\Delta t = {t_2} – {t_1}\): sự biến thiên thời gian
Lời giải:
a) Tốc độ của phản ứng thủy phân aspirin theo thời gian:
+ Từ 0h đến 2h: \(\overline v = – \frac{1}{1}.\frac{{5,{{51.10}^{ – 3}} – 5,{{55.10}^{ – 3}}}}{{2 – 0}} = {2.10^{ – 5}}\)
+ Từ 2h đến 5h: \(\overline v = – \frac{1}{1}.\frac{{5,{{45.10}^{ – 3}} – 5,{{51.10}^{ – 3}}}}{{5 – 2}} = {2.10^{ – 5}}\)
…
+ Tương tự ta sẽ có bảng kết quả như sau:
|
Thời gian (h) |
Nồng độ aspirin (M) |
Nồng độ salicylic acid (M) |
Tốc độ phản ứng (M/h) |
|
0 |
5,55.10-3 |
0 |
0 |
|
2 |
5,51.10-3 |
0,040.10-3 |
2.10-5 |
|
5 |
5,45.10-3 |
0,10.10-3 |
2.10-5 |
|
10 |
5,35.10-3 |
0,20.10-3 |
2.10-5 |
|
20 |
5,15.10-3 |
0,40.10-3 |
2.10-5 |
|
30 |
4,96.10-3 |
0,59.10-3 |
1,9.10-5 |
|
40 |
4,78.10-3 |
0,77.10-3 |
1,8.10-5 |
|
50 |
4,61.10-3 |
0,94.10-3 |
1,7.10-5 |
|
100 |
3,83.10-3 |
1,72.10-3 |
1,56.10-5 |
|
200 |
2,64.10-3 |
2,91.10-3 |
1,19.10-5 |
|
300 |
1,82.10-3 |
3,73.10-3 |
8,2.10-6 |
b) Trong 20 giờ đầu tiên, tốc độ phản ứng không đổi do nồng độ aspirin đủ lớn để duy trì tốc độ đó. Sau 20 giờ đầu tiên đó, nồng độ aspirin không đủ lớn khiến cho tốc độ phản ứng giảm dần theo thời gian
c) Đồ thị biểu diễn sự biến thiên của nồng độ chất tham gia và sản phẩm theo thời gian: