Giải Câu 14.11 Bài 14. Tính biến thiên enthalpy của phản ứng hóa học (trang 56, 57, 58) – SBT Hóa 10 Chân trời sáng tạo. Gợi ý: Dựa vào công thức \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \.
Câu hỏi/Đề bài:
Chloromethane (CH3Cl), còn được gọi là methyl chloride, Refrigerant-40 hoặc HCC 40. CH3Cl từng được sử dụng rộng rãi như một chất làm lạnh. Hợp chất khí này rất dễ cháy, có thể không mùi hoặc có mùi thơm nhẹ.
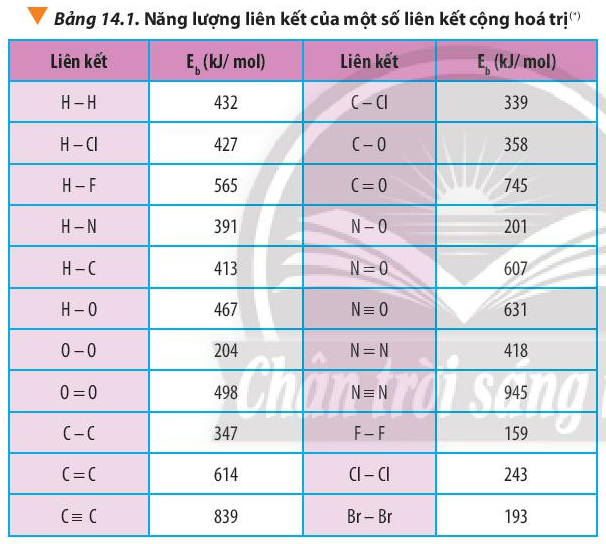
Từ năng lượng của các liên kết (Bảng 14.1 SGK), hãy tính biến thiên enthalpy của phản ứng tạo thành chloromethane:
CH4(g) + Cl2(g) -> CH3Cl(g) + HCl(g)
Cho biết phản ứng dễ dàng xảy ra dưới ánh sáng mặt trời. Kết quả tính có mâu thuẫn với khả năng dễ xảy ra của phản ứng không?
Hướng dẫn:
Dựa vào công thức \({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \) và bảng số liệu
Lời giải:
Biến thiên enthalpy của phản ứng CH4(g) + Cl2(g) ” CH3Cl(g) + HCl(g) là:
\({\Delta _r}H_{298}^0 = \sum {{E_b}(cd)} – \sum {{E_b}(sp)} \)
=> \({\Delta _r}H_{298}^0 = {\rm{(}}4.{E_b}(C – H) + {E_b}(Cl – Cl){\rm{)}} – {\rm{(}}3.{E_b}(C – H) + {E_b}(C – Cl) + {E_b}(H – Cl){\rm{)}}\)
=> \({\Delta _r}H_{298}^0 = (4.413 + 243) – (3.413 + 339 + 427) = – 110kJ\) < 0
=> Phản ứng xảy ra ” Kết quả tính toán phù hợp với thực tế phản ứng xảy ra dễ dàng trong điều kiện có ánh sáng